文獻解讀:鐵富集癌相關成纖維細胞促進腫瘤免疫抑制的研究過程
鐵,是維持人體正常生理功能所必需的微量金屬營養元素。例如,在氧氣運輸、呼吸鏈電子傳遞、氧化還原平衡、大分子生物合成等方面,鐵起到至關重要的作用。鐵代謝失衡會引發多種免疫相關疾病,例如:鐵缺失會導致B細胞細胞周期停滯并引發B細胞譜系發育受阻;鐵超載則會促進CD4+T細胞病理性擴增,引發紅斑狼瘡的自身免疫表型。癌癥本身也是異常增殖細胞逃避免疫系統監視,免受免疫細胞殺傷和清除的綜合性疾病。然而,鐵元素,特別是鐵代謝,在癌癥發生和惡性進展中起到何種作用,在腫瘤微環境中如何調控抗腫瘤免疫,這些科學問題仍然知之甚少。
最近,上海交通大學醫學院附屬仁濟醫院朱鶴研究員團隊,發現在前列腺癌微環境中存在一群鐵富集的癌相關成纖維細胞,根據英文縮寫(Ferrum iron CAFs)作者將其命名為FerroCAF。FerroCAF在PCa中的比例隨疾病進展而升高,并通過鐵依賴的表觀遺傳學機制,促進PCa腫瘤免疫抑制。該項研究是繼成肌纖維型CAF(myCAF)、免疫調節型CAF(iCAF)、抗原遞呈型CAF(apCAF)、衰老型CAF(senCAF)等相繼被報道后,我國學者揭示的促癌CAF新亞型:FerroCAF。

《Nature Communications》
研究材料和方法
作者利用單細胞測序技術(scRNA-seq)、多種前列腺癌(prostate cancer, PCa)轉基因小鼠模型、前列腺癌臨床組織樣本,普魯士藍鐵染色、連續切片免疫組化和免疫熒光染色、Ferro-Orange胞內鐵探針流式檢測技術,揭示了鐵富集的CAF在包括前列腺癌、肺癌、卵巢癌等多種惡性腫瘤中普遍存在。值得一提的是:作者在驗證FerroCAF通過分泌髓系細胞相關分泌蛋白(myeloid cell associated secretory protein, MASP)如CXCL1, CCL2, CSF1等募集髓系來源抑制性細胞MDSC、腫瘤相關巨噬細胞TAM等,促進腫瘤免疫抑制的研究中,使用了賽業生物(Cyagen)的C-NKG免疫缺陷型小鼠,并闡明了FerroCAFs發揮免疫抑制效應依賴于免疫細胞的功能。
技術路線

實驗結果
1. 新型鐵富集CAF在前列腺癌中隨疾病進展而富集
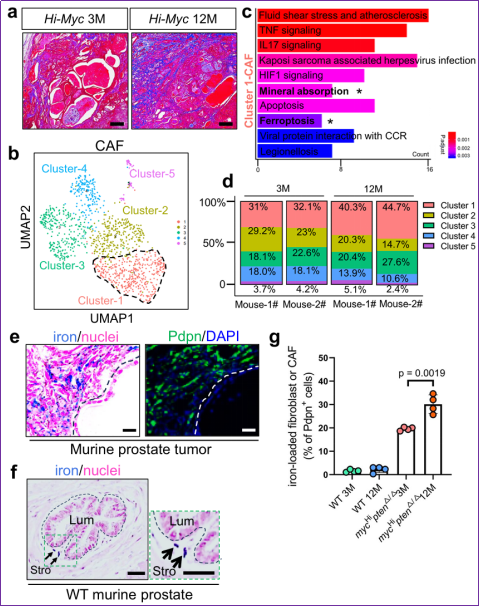
圖1 新型鐵富集CAF在前列腺癌中隨疾病進展而富集
作者利用scRNA-seq技術對感興趣的CAF組分進行聚類,發現Cluster-1是唯一一群既隨著腫瘤進展(從3月到12月)比例上升,且在兩個時間點,占CAF中比例最高的亞群。KEGG分析揭示,Cluster-1有“元素吸收”和“鐵死亡”兩個關鍵特征。由于Cluster-1比例隨著腫瘤生長而升高,并未發生鐵死亡,作者進而從鐵代謝的方向入手,通過普魯士藍鐵染色實驗,揭示了在腫瘤組織的基質區域存在一群鐵富集的stromal cell。在補充數據中,作者利用連續組織切片,發現這群鐵富集的stromal cell表達CAF標志物:PDPN,αSMA,PDGFR,S100A4,Vimentin等,同時不表達上皮Cd326/EpCam,不表達內皮Cd31,不表達免疫Cd45等譜系標記物,因此作者將其命名為鐵富集的癌相關成纖維細胞FerroCAF。
2. FerroCAF的特異性標記物為Pvr,且分泌MASP細胞因子和炎性因子
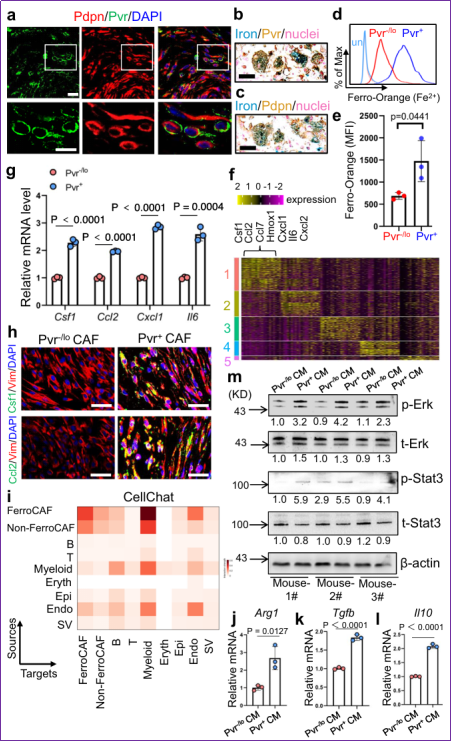
圖2 FerroCAF的特異性標記物為Pvr,且分泌MASP細胞因子和炎性因子
作者利用scRNA-seq分析發現Cluster-1 FerroCAF特異性高表Pvr (poliovirus receptor), 進而用免疫熒光染色等方法驗證了Pvr是FerroCAF可靠的特異性細胞表面標記物,并且在小鼠和人類前列腺癌FerroCAF中具有種屬保守型。在FerroCAF排名靠前的差異表達基因中,絕大部分是髓系來源抑制性細胞(Myeloid Derived Suppressor Cell, MDSC)和腫瘤相關巨噬細胞(Tumor Associated Macrophage, TAM)相關的細胞因子和炎性因子,作者將其定義為MASP,包括CSF1,CCL2,CCL7,CXCL1,CXCL2等。這提示FerroCAFs可能通過MASP招募MDSC和TAM在腫瘤微環境中大量聚集。作者利用CellChat分析、條件性培養基刺激等實驗闡明FerroCAFs和MDSC存在很強的“細胞-細胞通訊”活性,促進髓系細胞高表達Arg1, Il10,Tgfb等免疫抑制性因子。
3. FerroCAF鐵富集是由Hmox1高表達催化Heme降解釋放游離鐵導致
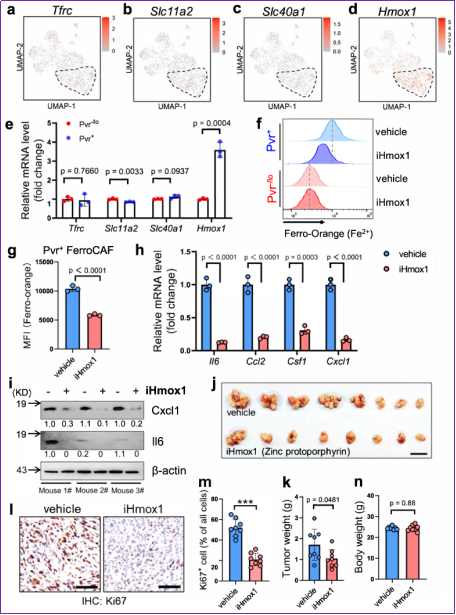
圖3 FerroCAF鐵富集是由Hmox1高表達催化Heme降解釋放游離鐵導致
作者進而探究了導致FerroCAF鐵富集表型的產生機制,研究者發現FerroCAF和其他CAF亞型相比,鐵攝取、鐵外排、鐵儲存等相關基因均無顯著差異。有趣的是,和鐵代謝密切相關的血紅素加氧酶Hmox1在FerroCAF中高表達,Hmox1的經典生物學功能在于催化Heme降解,并釋放游離鐵Fe2+導致鐵富集。作者為了驗證該假說,利用Hmox1抑制劑(Zn-PP, iHmox1)和Hmox1敲低等方法,發現抑制或下調Hmox1之后,FerroCAF中鐵含量顯著下降,并且MASP的轉錄表達也受到顯著抑制。
4. Hmox1抑制劑能顯著抑制MDSC和TAM募集,并促進T細胞浸潤和抗腫瘤免疫
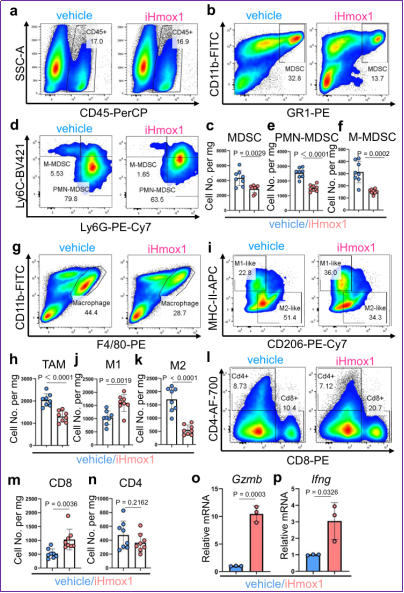
圖4 Hmox1抑制劑顯著抑制MDSC和TAM募集,并促進T細胞浸潤
作者接著利用同種移植實驗將FerroCAF和小鼠PCa細胞混合后,使用了C-NKG免疫缺陷型小鼠(由賽業生物提供)對C57BL/6小鼠(雄性)進行前列腺原位同種移植實驗。隨機分組后,一組用Hmox1抑制劑Zn-PP(iHmox1)進行給藥,另一組則用vehicle作為對照處理。作者在實驗終點比較了上述兩組小鼠的腫瘤大小、質量、增殖等指標,發現Hmox1抑制劑能顯著抑制原位前列腺癌腫瘤生長。作者進而利用流式細胞術分析了腫瘤內MDSC、TAM、T細胞等浸潤情況。盡管Hmox1抑制劑并未影響總體免疫細胞浸潤,但深刻改變了瘤內免疫細胞的組分:MDSC(包括PMN-MDSC和M-MDSC)和促癌型M2-TAM的數量均顯著下調;而抑癌型M1-TAM和Cd8+ T細胞的數量則顯著增加。Hmox1抑制劑也促進了T細胞殺傷性相關基因如Gzmb、Ifng等表達。
5. FerroCAF中鐵富集激活Kdm6b介導的表觀遺傳重編程啟動MASP轉錄
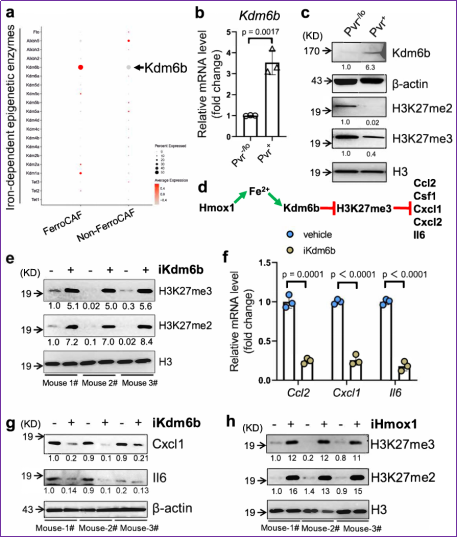
圖5 FerroCAF鐵富集激活Kdm6b介導的表觀遺傳重編程啟動MASP轉錄表達
作者進而探索鐵富集的表型如何介導MASP的表達。由于CAF和cancer cell相比,其genetic層面的突變相對較少,其促癌功能的獲得更多是由于epigenetic層面改變導致。基于此,作者設想鐵富集可能激活了鐵依賴的表觀遺傳學酶功能。為了驗證該假說,作者檢測FerroCAF中高表達的鐵依賴的表觀遺傳因子,結果發現組蛋白去甲基化酶Kdm6b(催化H3K27me3去甲基化修飾)在FerroCAFs中顯著性上調。生化實驗驗證了Kdm6b在FerroCAF中表達上調,以及H3K27me3修飾在FerroCAFs中水平下調。作者還利用CUT&Tag實驗揭示,在Hmox1敲除后(Hmox1-KO)的FerroCAF中,和對照相比,anti-H3K27me3 antibody和DNA結合明顯增強,在MASP相關的gene locus,H3K27me3的mark也顯著上調。這提示:從Hmox1/iron/Kdm6b信號軸上游敲除Hmox1,能誘發下游Kdm6b活性被抑制,導致MASP基因在內的全基因組H3K27me3修飾增強,導致MASP相關基因轉錄抑制。
6. FerroCAF在前列腺癌中富集程度預示較差的臨床預后
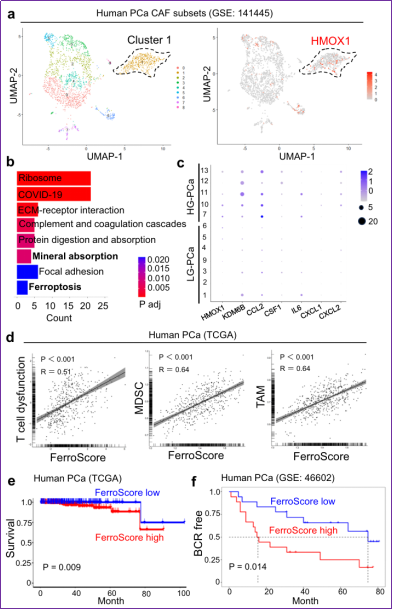
圖6 FerroCAF在前列腺腫瘤中的富集程度預示著較差的臨床預后
最后作者利用已發表的臨床PCa的單細胞測序數據、TCGA數據等,將FerroCAF的特征性基因(signature genes):HMOX1、KDM6B、PVR、IL6、CCL2、CSF1、CXCL1等合并為一個基因集,命名為FerroScore用來反映FerroCAF的富集程度。結果顯示:作者不僅在其他發表的scRNA-seq數據中找到了FerroCAF亞型的存在,也通過生信分析等手段揭示了FerroCAF的富集預示較高的免疫抑制性特征和較短的患者生存期。研究人員還檢測了FerroCAF在其他類型癌癥中的存在和臨床相關性。令人意外的是,作者通過增強型普魯士藍鐵染色、生信分析等方法,揭示FerroCAF在臨床肺癌樣本、卵巢癌樣本中均存在HMOX1高表達、鐵富集的FerroCAF。和前列腺癌類似,肺癌、卵巢癌中FerroCAF的富集程度中也預示著較高的免疫抑制性特征和較短的生存期。這提示FerroCAF在多種人類惡性腫瘤中廣泛存在,也預示通過阻斷Hmox1/iron/Kdm6b信號,抑制FerroCAF活性,能激活抗腫瘤免疫活性的廣譜可適性。
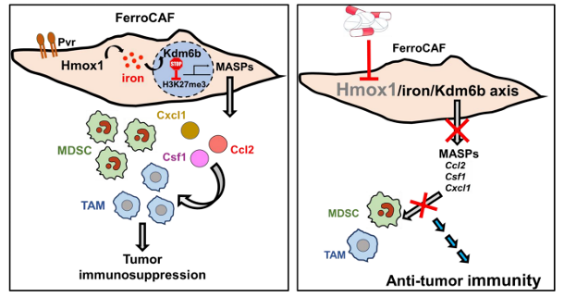
圖7 阻斷Hmox1/iron/Kdm6b信號,抑制FerroCAF活性,進而激活抗腫瘤免疫在多種癌癥中具有廣譜可適性
實驗結論
作者在前列腺癌微環境中揭示了一群未被報道的“鐵富集的癌相關成纖維細胞(FerroCAF)”,利用生信分析、生化、細胞和動物實驗闡明了FerroCAF中鐵富集表型是由血紅素加氧酶Heme Oxygenase 1 (Hmox1)高表達、催化血紅素heme降解導致游離鐵釋放導致;鐵聚集進而激活鐵依賴的組蛋白去甲基化酶Kdm6b,后者促進髓系細胞相關分泌蛋白(myeloid cell associated secretory protein, MASP)如CXCL1, CCL2, CSF1等轉錄表達,募集髓系來源抑制性細胞MDSC、腫瘤相關巨噬細胞TAM等,促進前列腺癌腫瘤免疫抑制。作者明確了Hmox1/iron/Kdm6b信號軸在維持FerroCAF細胞鐵富集表型、促腫瘤免疫抑制活性方面的關鍵作用。基于此,作者提出:通過抑制劑干預Hmox1/iron/Kdm6b信號軸,能有效抑制FerroCAF活性、促進Cd8+T細胞浸潤、激活抗腫瘤免疫活性的治療策略。作者還在其他癌癥類型,例如小細胞肺癌、肺腺癌、惡性卵巢癌臨床組織樣本中也證實了FerroCAF跨癌種存在,也提示阻斷FerroCAF免疫抑制活性,激活以前列腺癌為代表的“冷腫瘤”的抗腫瘤免疫活性,具有廣譜可適性。





