腺相關病毒AAV在腎臟組織研究中的靶向策略介紹
AAV(腺相關病毒)因其免疫原性低、安全性高、宿主范圍廣、組織特異性、長期穩定表達等特點,已被廣泛的應用在動物水平的基因表達、基因操作和基因治療。全球腎病患者規模龐大,選擇AAV治療是因其能夠精準靶向腎臟細胞,減少對其他器官的影響。AAV在腎臟組織的靶向策略需要綜合考慮血清型選擇、啟動子使用和注射方式等多個因素,以優化基因治療的效率和特異性。接下來,讓我們一起學習AAV在腎臟組織中的應用。
腎臟的基本信息
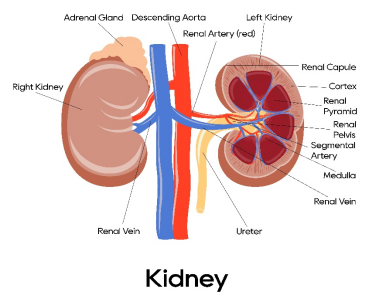
腎臟是人體的重要器官,具有清除體內代謝產物及某些廢物、毒物,調節水、電解質平衡及維護酸堿平衡、內分泌功能等功能,保證了機體內環境的穩定,使新陳代謝得以正常進行。腎臟疾病是全球性的公共衛生問題。據悉,全球有約8.5億人患有腎臟疾病,而中國慢性腎臟病患者已超過1個億。
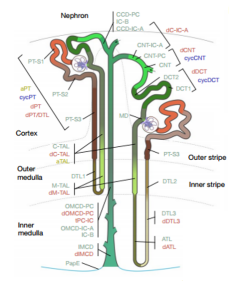
腎臟結構復雜、細胞種類多樣。通過眾多研究人員[1]的努力,繪制出了最全面的人類腎臟組織圖譜(圖2)。這個腎臟組織圖譜包括51種主要腎臟細胞類型,主要細胞類型為以下幾種:
1. 腎小球內皮細胞:構成腎小球毛細血管壁的一部分,參與濾過過程。
2. 足細胞(臟層上細胞):位于腎小球基底膜的一側,與內皮細胞和基底膜共同構成濾過屏障。
3. 腎小管上皮細胞:根據腎小管的不同部位,上皮細胞具有不同的形態和功能,參與重吸收和分泌過程。
4. 集合管細胞:負責進一步調節尿液的組成。
5. 間質細胞:包括成纖維細胞、平滑肌細胞等,構成腎臟的支持結構。
6. 腎小球旁器細胞:參與腎素的分泌,參與調節血壓。
一、不同血清型對腎臟的侵染
研究人員通過不同的給藥方式驗證了多種血清型對腎臟的侵染能力,結果表明AAV9血清型對于腎臟侵染能力最強。
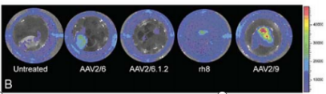
Chung D C等人[2],采用輸尿管逆行注射的注射方式對比rAAV1,rAAV2,rAAV5,rAAV6,AAV6.1.2,AAV.rh8,rAAV7,rAAV8和rAAV9對于小鼠腎臟的侵染效率,發現rAAV8和rAAV9能夠有效地感染小鼠腎小管細胞(圖3)。
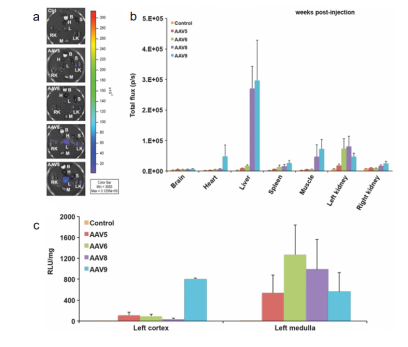
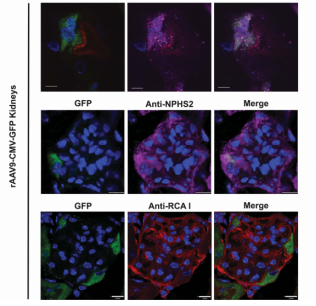
在另一項研究中, Rocca C J 等人[3]通過腎靜脈注射,對比了rAAV5,rAAV6,rAAV8和rAAV9在小鼠腎臟中的表達情況。實驗結果表明rAAV6和rAAV8通過腎靜脈注射能夠轉染腎臟,但主要局限于腎髓質區域,而rAAV9則能夠高效轉染腎皮質和髓質兩個區域(圖4)。共聚焦顯微鏡發現注射rAAV9 - GFP的腎臟中近端小管和腎小球呈GFP陽性,在腎小球中,足細胞和系膜細胞中均檢測到GFP(圖5)。
二、腎臟特異性啟動子
腎臟中細胞結構復雜,種類較多。在一些研究中,目的基因不需要特異性表達可以采用CMV啟動子,也可以針對不同的腎臟細胞采用對應的特異性啟動子獲得最佳的感染效果。
腎小管特異性啟動子
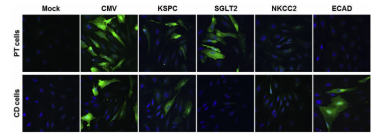
Asico等人[4]使用輸尿管給藥的方式對比了CMV,KSPC,SGLT2,NKCC2和ECAD啟動子,在小鼠腎臟中的特異性表達情況(圖6)。結果表明:
CMV啟動子:可以在近端小管(PT)和集合管(CD)細胞中提供強烈的GFP表達。
KSPC啟動子:可以在整個腎小管(從近端小管到集合管)中提供基因表達。
SGLT2啟動子:可以在近端小管細胞中提供表達,但不能在集合管細胞中表達。
NKCC2啟動子:在近端小管和集合管細胞中的表達都很微弱。
ECAD啟動子:僅在集合管細胞中提供表達,而不能在近端小管細胞中表達[4]。
足細胞特異性啟動子
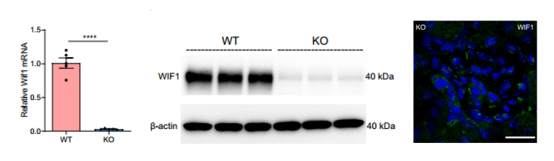
CLDN5在足細胞中的缺失導致WNT抑制劑WIF1的表達降低,從而激活了WNT信號通路。這種WNT信號失調導致了足細胞損傷、蛋白尿和小鼠糖尿病腎病和梗阻性腎病模型中的腎臟纖維化。研究人員使用NPHS1特異性啟動子病毒通過腎原位注射,在足細胞中過表達了WIF1(圖7),和對照AAV處理的突變小鼠相比,WIF1處理組的足細胞損失顯著減少[5]。
腎臟上皮細胞特異性啟動子
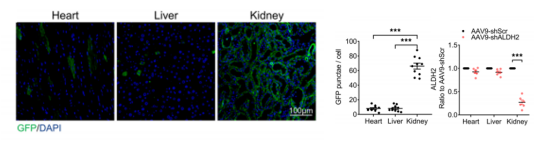
ALDH2缺乏會加重腎損傷。為了抑制ALDH2基因在RTECs中的表達,Xu, Tonghui等人[6]通過尾靜脈注射AAV9-Ksp-GFP-shALDH2病毒,發現CI-AKI小鼠表現出更嚴重的腎損傷和腎小管上皮細胞凋亡。研究發現,Ksp啟動子心臟和肝臟中很少表達,在腎小管上皮細胞中大量表達(圖8),說明Ksp啟動子有較強的腎臟上皮細胞的特異性。
三、腎臟不同的注射方式
選擇合適的給藥途徑是基因治療重要的因素。腎臟最常用的給藥方式為腎臟實質注射、腎盂內注射和輸尿管給藥。
哺乳動物的腎臟有過濾功能,排斥大于50KD的蛋白質,此外,腎小球內的足細胞形成直徑僅為10nm的狹縫橫隔膜,傳統的AAV載體全身給藥難以在腎臟達到足夠的表達水平。為了提高病毒載體對腎臟的轉導,除了全身給藥方式,研究人員陸續開發了多種腎臟局部給藥方法。為此,小編匯總成了表1,并將其中常用的幾種腎臟給藥方法具體步驟列在下方,以供大家參考。
表1:AAV腎臟給藥方法
腎臟實質注射:
①動物準備:首先,對實驗動物進行麻醉,并確保動物在手術過程中保持穩定。
②剃毛和消毒:在動物的腹部進行剃毛,并使用適當的消毒劑清潔皮膚,以減少手術感染的風險。
③暴露腎臟:在動物腹部做一個小切口,暴露出腎臟。
④注射準備:使用適當大小的注射針(通常為26G或30G),準備含有所需AAV滴度的病毒溶液。
⑤注射操作:將注射針緩慢插入腎臟實質中,通常在腎皮質的多個位置進行注射,以確保病毒分布均勻。注射體積和滴度根據實驗設計和病毒類型而定。
⑥止血和縫合:注射后,使用止血材料輕輕按壓注射點,以幫助止血。然后,將切口分兩層縫合,即肌肉層和皮膚層。
經輸尿管腎盂逆行注射:
①對C57BL/6小鼠(4-6 周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②在小鼠左腹部做一個切口并輕輕剖開,找到輸尿管遠端和腎動脈并用顯微止血夾夾住;
③用30G注射針刺破輸尿管,將注射針貼合于管壁并固定到位,使用6-0縫線縫合以防液體泄漏;
④將尿液輕輕吸出,將注射器替換為另一個含有約 50µL液體(含有病毒顆粒或PBS)的注射器,并緩慢地將液體逆行注入輸尿管;
⑤將注射針撤出,并在注射部位的近端放置一個顯微止血夾以防液體泄漏;
⑥5min后,移去輸尿管遠端、近端及腎動脈上的顯微止血夾,用6-0縫線將切口分兩層縫合。
腎靜脈注射:
①對C57BL/6 小鼠(4-6周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②給小鼠左腹剃毛,在小鼠左腹部做一個切口,暴露左腎及腎蒂,并將腎靜脈從腎蒂中游離;
③用顯微止血夾夾住腎靜脈遠端以阻止病毒原液流出腎臟;
④用30G注射針刺入左腎靜脈近端,將50µL液體(含有病毒顆粒或PBS)注入腎靜脈;
⑤5min后,拔出注射針,移去顯微止血夾并壓迫止血片刻,將切口分兩層縫合。
經腎實質腎盂注射:
①對C57BL/6 小鼠(4-6周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②對小鼠左腹進行剃毛處理,切開一個2cm的切口暴露左腎和輸尿管,并將周圍器官和脂肪輕輕分開;
③用顯微止血夾夾住輸尿管上段以阻止病毒原液下流至膀胱;
④用30G注射針刺入左腎中極的腎盂(注意注射針頭不應刺穿腎盂),將50µL液體(含病毒顆粒或PBS)注入腎盂。
⑤5min后移去顯微止血夾,將切口分兩層縫合。
References
[1]. Lake, B.B., et al., An atlas of healthy and injured cell states and niches in the human kidney. Nature, 2023.
[2]. Chung, D.C., et al., Adeno-Associated Virus-Mediated Gene Transfer to Renal Tubule Cells via a Retrograde Ureteral Approach. Nephron Extra, 2011. 1(1): p. 217-223.
[3]. Rocca, C.J., et al., rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy, 2014. 21(6): p. 618-628.
[4]. Asico, et al., Nephron segment-specific gene expression using AAV vectors. Biochemical and Biophysical Research Communications, 2018. 497(1): p. 19-24.
[5]. Yan, J., et al., Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease. 2021.
[6]. Xu, T., et al., Aldehyde Dehydrogenase 2 Protects Against Acute Kidney Injury by Regulating Autophagy via PI3KC3/Beclin-1 Pathway. SSRN Electronic Journal, 2020.
[7]. Stephanie Schievenbusch, I.S.M.S., Combined Paracrine and Endocrine AAV9‑mediated Expression of Hepatocyte Growth Factor for the Treatment of Renal Fibrosis. Molecular Therapy, 2010.
[8]. Peng Wang, M.L.E.S., Long noncoding RNA lnc-TSI inhibits renal fibrogenesis by negatively regulating the TGF-β/Smad3 pathway. Sci. Transl. Med, 2018.
[9]. Jing, X., et al., Gene deficiency or pharmacological inhibition of PDCD4-mediated FGR signaling protects against acute kidney injury. 藥學學報:英文版, 2021(002): p. 000.
[10]. Yan, et al., Comparison of the transduction efficiency of tyrosine-mutant adeno-associated virus serotype vectors in kidney. Clinical & Experimental Pharmacology & Physiology, 2013.
[11]. Chen, Q.Q., et al., Neuraminidase 1 promotes renal fibrosis development in male mice. Nature Communications, 2023. 14(1).
[12]. Wei Zhou, M.C.H.L., Dihydroartemisinin suppresses renal fibrosis in mice by inhibiting DNA-methyltransferase 1 and increasing Klotho. 中國藥理學報:英文版, 2022(10): p. 2609-2623.
腎臟的基本信息
腎臟是人體的重要器官,具有清除體內代謝產物及某些廢物、毒物,調節水、電解質平衡及維護酸堿平衡、內分泌功能等功能,保證了機體內環境的穩定,使新陳代謝得以正常進行。腎臟疾病是全球性的公共衛生問題。據悉,全球有約8.5億人患有腎臟疾病,而中國慢性腎臟病患者已超過1個億。

圖1. 人體腎臟解剖圖
腎臟結構復雜、細胞種類多樣。通過眾多研究人員[1]的努力,繪制出了最全面的人類腎臟組織圖譜(圖2)。這個腎臟組織圖譜包括51種主要腎臟細胞類型,主要細胞類型為以下幾種:
1. 腎小球內皮細胞:構成腎小球毛細血管壁的一部分,參與濾過過程。
2. 足細胞(臟層上細胞):位于腎小球基底膜的一側,與內皮細胞和基底膜共同構成濾過屏障。
3. 腎小管上皮細胞:根據腎小管的不同部位,上皮細胞具有不同的形態和功能,參與重吸收和分泌過程。
4. 集合管細胞:負責進一步調節尿液的組成。
5. 間質細胞:包括成纖維細胞、平滑肌細胞等,構成腎臟的支持結構。
6. 腎小球旁器細胞:參與腎素的分泌,參與調節血壓。

圖2. 腎臟組織圖譜[1]
一、不同血清型對腎臟的侵染
研究人員通過不同的給藥方式驗證了多種血清型對腎臟的侵染能力,結果表明AAV9血清型對于腎臟侵染能力最強。
Chung D C等人[2],采用輸尿管逆行注射的注射方式對比rAAV1,rAAV2,rAAV5,rAAV6,AAV6.1.2,AAV.rh8,rAAV7,rAAV8和rAAV9對于小鼠腎臟的侵染效率,發現rAAV8和rAAV9能夠有效地感染小鼠腎小管細胞(圖3)。

圖3. 不同血清型對腎小管的侵染[2]
在另一項研究中, Rocca C J 等人[3]通過腎靜脈注射,對比了rAAV5,rAAV6,rAAV8和rAAV9在小鼠腎臟中的表達情況。實驗結果表明rAAV6和rAAV8通過腎靜脈注射能夠轉染腎臟,但主要局限于腎髓質區域,而rAAV9則能夠高效轉染腎皮質和髓質兩個區域(圖4)。共聚焦顯微鏡發現注射rAAV9 - GFP的腎臟中近端小管和腎小球呈GFP陽性,在腎小球中,足細胞和系膜細胞中均檢測到GFP(圖5)。

圖4. 腎靜脈注射不同血清型對腎臟和其他器官的侵染[3]

圖5. AAV9侵染腎臟免疫熒光圖片[3]
二、腎臟特異性啟動子
腎臟中細胞結構復雜,種類較多。在一些研究中,目的基因不需要特異性表達可以采用CMV啟動子,也可以針對不同的腎臟細胞采用對應的特異性啟動子獲得最佳的感染效果。
腎小管特異性啟動子
Asico等人[4]使用輸尿管給藥的方式對比了CMV,KSPC,SGLT2,NKCC2和ECAD啟動子,在小鼠腎臟中的特異性表達情況(圖6)。結果表明:
CMV啟動子:可以在近端小管(PT)和集合管(CD)細胞中提供強烈的GFP表達。
KSPC啟動子:可以在整個腎小管(從近端小管到集合管)中提供基因表達。
SGLT2啟動子:可以在近端小管細胞中提供表達,但不能在集合管細胞中表達。
NKCC2啟動子:在近端小管和集合管細胞中的表達都很微弱。
ECAD啟動子:僅在集合管細胞中提供表達,而不能在近端小管細胞中表達[4]。

圖6. 不同啟動子在腎臟中的表達情況[4]
足細胞特異性啟動子
CLDN5在足細胞中的缺失導致WNT抑制劑WIF1的表達降低,從而激活了WNT信號通路。這種WNT信號失調導致了足細胞損傷、蛋白尿和小鼠糖尿病腎病和梗阻性腎病模型中的腎臟纖維化。研究人員使用NPHS1特異性啟動子病毒通過腎原位注射,在足細胞中過表達了WIF1(圖7),和對照AAV處理的突變小鼠相比,WIF1處理組的足細胞損失顯著減少[5]。

圖7. rAAV9-NPHS1-WIF1在腎臟表達情況[5]
腎臟上皮細胞特異性啟動子
ALDH2缺乏會加重腎損傷。為了抑制ALDH2基因在RTECs中的表達,Xu, Tonghui等人[6]通過尾靜脈注射AAV9-Ksp-GFP-shALDH2病毒,發現CI-AKI小鼠表現出更嚴重的腎損傷和腎小管上皮細胞凋亡。研究發現,Ksp啟動子心臟和肝臟中很少表達,在腎小管上皮細胞中大量表達(圖8),說明Ksp啟動子有較強的腎臟上皮細胞的特異性。

圖8. AAV9-Ksp-GFP-shALDH2在腎臟表達情況[6]
三、腎臟不同的注射方式
選擇合適的給藥途徑是基因治療重要的因素。腎臟最常用的給藥方式為腎臟實質注射、腎盂內注射和輸尿管給藥。
哺乳動物的腎臟有過濾功能,排斥大于50KD的蛋白質,此外,腎小球內的足細胞形成直徑僅為10nm的狹縫橫隔膜,傳統的AAV載體全身給藥難以在腎臟達到足夠的表達水平。為了提高病毒載體對腎臟的轉導,除了全身給藥方式,研究人員陸續開發了多種腎臟局部給藥方法。為此,小編匯總成了表1,并將其中常用的幾種腎臟給藥方法具體步驟列在下方,以供大家參考。
表1:AAV腎臟給藥方法
| 注射方式 | 注射量 | 血清型 | 動物模型 |
| 尾靜脈注射[6] | 5E11-1E12vg | AAV9 | 小鼠 |
| 腎靜脈注射[3, 8] | 5E10-1E12vg | AAV9 | 小鼠 |
| 腎臟實質注射[3, 8] | 1E11vg | AAV9 | 小鼠 |
| 腎盂內注射[12] | 1E11vg | AAV9 | 小鼠 |
| 輸尿管給藥[2, 4] | 1E11vg | AAV9 | 小鼠 |
①動物準備:首先,對實驗動物進行麻醉,并確保動物在手術過程中保持穩定。
②剃毛和消毒:在動物的腹部進行剃毛,并使用適當的消毒劑清潔皮膚,以減少手術感染的風險。
③暴露腎臟:在動物腹部做一個小切口,暴露出腎臟。
④注射準備:使用適當大小的注射針(通常為26G或30G),準備含有所需AAV滴度的病毒溶液。
⑤注射操作:將注射針緩慢插入腎臟實質中,通常在腎皮質的多個位置進行注射,以確保病毒分布均勻。注射體積和滴度根據實驗設計和病毒類型而定。
⑥止血和縫合:注射后,使用止血材料輕輕按壓注射點,以幫助止血。然后,將切口分兩層縫合,即肌肉層和皮膚層。
經輸尿管腎盂逆行注射:
①對C57BL/6小鼠(4-6 周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②在小鼠左腹部做一個切口并輕輕剖開,找到輸尿管遠端和腎動脈并用顯微止血夾夾住;
③用30G注射針刺破輸尿管,將注射針貼合于管壁并固定到位,使用6-0縫線縫合以防液體泄漏;
④將尿液輕輕吸出,將注射器替換為另一個含有約 50µL液體(含有病毒顆粒或PBS)的注射器,并緩慢地將液體逆行注入輸尿管;
⑤將注射針撤出,并在注射部位的近端放置一個顯微止血夾以防液體泄漏;
⑥5min后,移去輸尿管遠端、近端及腎動脈上的顯微止血夾,用6-0縫線將切口分兩層縫合。
腎靜脈注射:
①對C57BL/6 小鼠(4-6周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②給小鼠左腹剃毛,在小鼠左腹部做一個切口,暴露左腎及腎蒂,并將腎靜脈從腎蒂中游離;
③用顯微止血夾夾住腎靜脈遠端以阻止病毒原液流出腎臟;
④用30G注射針刺入左腎靜脈近端,將50µL液體(含有病毒顆粒或PBS)注入腎靜脈;
⑤5min后,拔出注射針,移去顯微止血夾并壓迫止血片刻,將切口分兩層縫合。
經腎實質腎盂注射:
①對C57BL/6 小鼠(4-6周齡,15-20g)進行麻醉手術,并使小鼠呈仰臥姿勢于操作臺上;
②對小鼠左腹進行剃毛處理,切開一個2cm的切口暴露左腎和輸尿管,并將周圍器官和脂肪輕輕分開;
③用顯微止血夾夾住輸尿管上段以阻止病毒原液下流至膀胱;
④用30G注射針刺入左腎中極的腎盂(注意注射針頭不應刺穿腎盂),將50µL液體(含病毒顆粒或PBS)注入腎盂。
⑤5min后移去顯微止血夾,將切口分兩層縫合。
References
[1]. Lake, B.B., et al., An atlas of healthy and injured cell states and niches in the human kidney. Nature, 2023.
[2]. Chung, D.C., et al., Adeno-Associated Virus-Mediated Gene Transfer to Renal Tubule Cells via a Retrograde Ureteral Approach. Nephron Extra, 2011. 1(1): p. 217-223.
[3]. Rocca, C.J., et al., rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy, 2014. 21(6): p. 618-628.
[4]. Asico, et al., Nephron segment-specific gene expression using AAV vectors. Biochemical and Biophysical Research Communications, 2018. 497(1): p. 19-24.
[5]. Yan, J., et al., Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease. 2021.
[6]. Xu, T., et al., Aldehyde Dehydrogenase 2 Protects Against Acute Kidney Injury by Regulating Autophagy via PI3KC3/Beclin-1 Pathway. SSRN Electronic Journal, 2020.
[7]. Stephanie Schievenbusch, I.S.M.S., Combined Paracrine and Endocrine AAV9‑mediated Expression of Hepatocyte Growth Factor for the Treatment of Renal Fibrosis. Molecular Therapy, 2010.
[8]. Peng Wang, M.L.E.S., Long noncoding RNA lnc-TSI inhibits renal fibrogenesis by negatively regulating the TGF-β/Smad3 pathway. Sci. Transl. Med, 2018.
[9]. Jing, X., et al., Gene deficiency or pharmacological inhibition of PDCD4-mediated FGR signaling protects against acute kidney injury. 藥學學報:英文版, 2021(002): p. 000.
[10]. Yan, et al., Comparison of the transduction efficiency of tyrosine-mutant adeno-associated virus serotype vectors in kidney. Clinical & Experimental Pharmacology & Physiology, 2013.
[11]. Chen, Q.Q., et al., Neuraminidase 1 promotes renal fibrosis development in male mice. Nature Communications, 2023. 14(1).
[12]. Wei Zhou, M.C.H.L., Dihydroartemisinin suppresses renal fibrosis in mice by inhibiting DNA-methyltransferase 1 and increasing Klotho. 中國藥理學報:英文版, 2022(10): p. 2609-2623.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





