載脂蛋白 E4 APOE4在遏制青光眼神經細胞丟失的應用
載脂蛋白 E4 (APOE4) 等位基因可增加阿爾茨海默病患病風險,卻能降低年齡相關的青光眼患病風險。青光眼主要特征為進行性視網膜神經節細胞 (RGC) 丟失,影響全球約 8000 萬人。氧化應激和線粒體功能障礙、神經營養因子缺失以及星形膠質細胞和小膠質細胞炎性反應被認為介導上述RGC的丟失。
在阿爾茨海默病、肌萎縮側索硬化癥 (ALS) 和多發性硬化癥中可通過APOE4將穩態的小膠質細胞轉變為疾病狀態,這些小膠質細胞也被稱為疾病相關的小膠質細胞。
2022年8月15日哈佛醫學院Oleg Butovsky研究團隊揭示了APOE4等位基因可減弱小膠質細胞神經退行性疾病表型,在青光眼模型中保護神經節細胞的作用,表明了 APOE4可作為阿爾茨海默病的“砒霜”,青光眼的“蜜餞”!

1、青光眼小鼠模型小膠質細胞狀態的改變
磁性微珠前房注射誘導高眼壓模型小鼠或青光眼模型基因小鼠視網膜中小膠質細胞的穩態基因(P2ry12, Tmem119, Tgfbr1,和Mef2a)表達下降,疾病相關的基因(Apoe, Lgals3,炎癥因子和補體信號)表達增加。免疫熒光實驗青光眼模型基因小鼠視網膜中小膠質細胞表達Apoe增加。
盡管眼壓依然較高,但在全敲除Apoe后青光眼模型小鼠可降低RGC的丟失。研究人員為了進一步確定特異性細胞類型的Apoe的作用,他們通過CX3CR1工具小鼠特異性敲除中樞神經系統髓系細胞(包括小膠質細胞和血管旁巨噬細胞)后可明顯減少磁性微珠前房注射引起的RGC丟失。
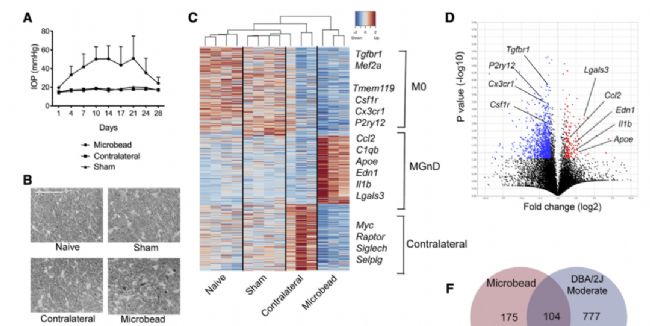
圖1:青光眼模型小鼠小膠質細胞轉錄組學特征
2、敲除Apoe后可維持小膠質細胞的穩態功能
單細胞測序技術發現注射磁珠引起野生型小鼠視網膜表現出疾病狀態相關小膠質細胞核心基因表達明顯增加,但在敲除Apoe后這些基因表達均下降,即便是表達增加最強的Lgals3也下降。
與接受無吞噬活性的穩態小膠質細胞相比,野生型小鼠眼球內接受具有吞噬能力的疾病狀態相關小膠質細胞注射后RGC數量減少。在敲除Apoe后可阻斷上述RGC的丟失,這就表明吞噬能力的疾病狀態相關小膠質細胞可直接引起RGC的退化。
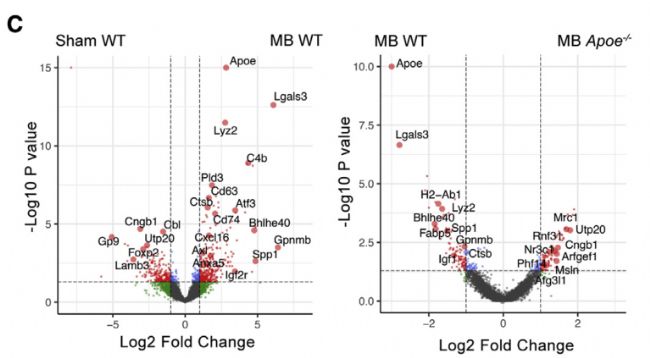
圖2:敲除Apoe視網膜小膠質細胞維持穩態
3、Apoe-Galectin-3信號保護神經節細胞的丟失
青光眼小鼠模型中小膠質細胞上Lgals3基因編碼的Galectin-3蛋白水平明顯升高,但在敲除Apoe后可阻斷Galectin-3蛋白的升高。進一步的實驗證實了敲除Lgals3或者Galectin-3蛋白抑制劑可明顯減少青光眼模型小鼠RGC的丟失。
人類 APOE 基因具有三個等位基因 APOE2、APOE3 和APOE4,其中APOE3是常見的等位基因。人源化APOE2、APOE3 小鼠眼球在接受微型磁珠注射后引起RGC胞體和軸突的明顯丟失,但在人源化APOE4小鼠中這種RGC的丟失得到遏制。
單細胞測序實驗證實了接受微型磁珠注射的人源化APOE3 小鼠小膠質細胞Apoe, Lgals3,炎癥因子和補體信號相關基因表達上調,而化APOE4 小鼠小膠質細胞基因維持穩態狀態。

圖3:敲除Lgals3保護神經節細胞
總結
本文通過兩種青光眼小鼠模型發現小膠質細胞由穩態轉變為神經退行性疾病相關的狀態(轉錄組學水平),并進一步揭示了小膠質細胞的APOE- Galectin-3信號通路在青光眼小鼠模型中發揮保護視網膜神經節細胞丟失的作用。

想了解更多內容,獲取相關咨詢請聯系
電話 : +86-0731-84428665
聯系人:伍經理 +86-180 7516 6076





