腸菌-腦軸-免疫:腸道菌群調控阿爾茨海默病的新機制
美國埃默里大學葉克強教授等人于2022年1月在Gut(IF 23.059)期刊發(fā)表題為“Gut microbiota regulate Alzheimer’s disease pathologies and cognitive disorders via PUFA associated neuroinflammation”的文章,該研究通過阿爾茨海默病(Alzheimer’s disease,AD)小鼠模型和人源化糞菌移植(FMT)實驗發(fā)現,AD相關腸道菌群(以擬桿菌屬富集為特征)可通過激活C/EBPβ/AEP通路,并上調促炎癥性的多不飽和脂肪酸(Poly-unsaturated fatty acid,PUFA)代謝,以增強小神經膠質細胞活化及神經炎癥,從而促進AD病理及認知障礙。這些發(fā)現支持行為缺陷、小膠質細胞激活和AD病理需要復雜的腸道微生物組,腸道微生物組有助于AD小鼠模型的病理,并且人類微生物組的失調可能是AD的危險因素。

研究材料
SPF 3×Tg AD小鼠、無菌小鼠(GF,3×Tg品系)、AD患者糞菌、3株擬桿菌屬菌株
技術路線
· 步驟1:腸道菌群可促進AD小鼠的AD病理、認知障礙及小神經膠質細胞活化,激活C/EBPβ/AEP通路,上調PUFA代謝相關促炎癥酶表達;
· 步驟2:腸道菌群增加小鼠大腦中的炎癥性代謝產物水平,調節(jié)炎癥性通路及胰島素/IGF-1通路,短鏈脂肪酸(SCFAs)驅動C/EBPβ/AEP通路活化、AD小鼠的認知障礙及炎癥;
· 步驟3:PUFA代謝相關擬桿菌屬菌株在移植了AD患者菌群的無菌小鼠中增加,增強小鼠的AD病理及認知障礙,促進C/EBPβ/AEP通路活化,并上調炎癥。
研究結果
1. 腸道菌群刺激3×Tg小鼠AD病理、認知缺陷和小膠質細胞激活
與SPF 3×Tg AD小鼠相比,3×Tg衍生GF小鼠海馬和纖維狀蛋白包涵體中的AT8、Aβ42減少,表明當腸道菌群耗盡時,AD病理得到緩解(圖1 A-C)。同時,Y迷宮中的行為表明,GF小鼠與SPF小鼠相比,空間記憶功能顯著改善(圖1 D、E)。半自動定量形態(tài)三維測量顯示,與SPF小鼠相比,GF小鼠的小膠質細胞形態(tài)發(fā)生了顯著改變(圖1 F-I)。
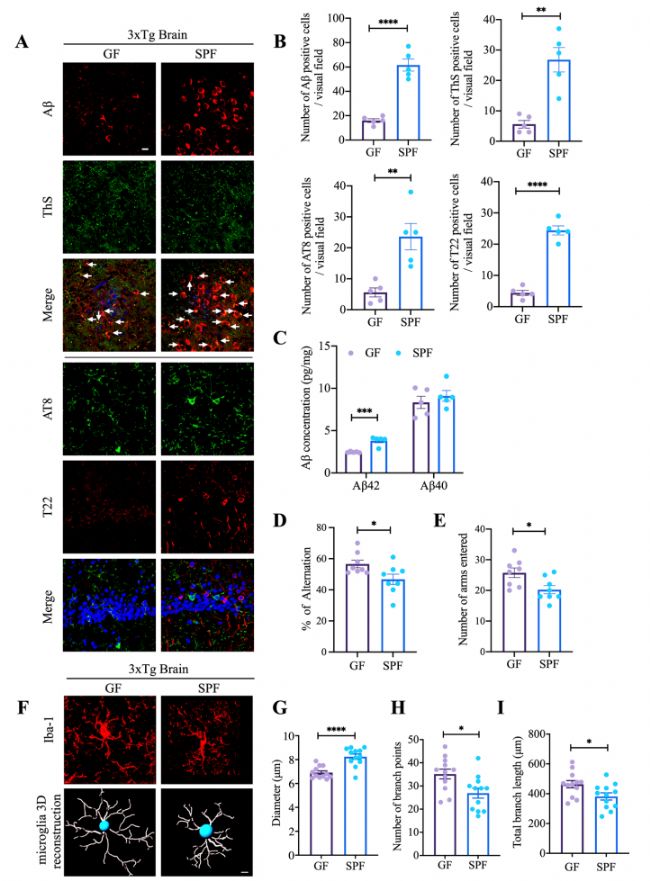
圖1 與SPF小鼠相比,無菌小鼠顯示出AD病理減少和認知功能改善
2. 腸道菌群激活C/EBPβ/AEP通路,提高PUFA代謝相關促炎酶表達水平
最近的研究表明C/EBPβ/AEP信號通路在時間和空間上調控AD病理,為了評估是否需要完整的腸道微生物組來刺激這一通路,從而導致AD發(fā)病機制,作者通過免疫印跡分析,發(fā)現與SFP小鼠相比,GF小鼠大腦中的C/EBPβ/AEP信號傳導減弱,作為記憶障礙導致AD發(fā)病和炎癥核心網絡的花生四烯酸(AA)代謝途徑相關的Lox5、Cox1和Cox2水平明顯降低(圖2 A、B)。蛋白酶測定顯示GF小鼠的AEP酶活性低于SPF小鼠,這與活性AEP水平降低保持一致(圖2 C)。GF小鼠中IL-6濃度(C/EBPβ是其主要轉錄因子)顯著降低(圖2 D)。qPCR結果顯示,GF小鼠的CEBPβ靶點/AA通路基因表達下降(圖2 E),與RNAseq數據趨勢一致。上述結果表明,復雜的腸道菌群促進AD小鼠模型的病理過程。
最近的研究表明C/EBPβ/AEP信號通路在時間和空間上調控AD病理,為了評估是否需要完整的腸道微生物組來刺激這一通路,從而導致AD發(fā)病機制,作者通過免疫印跡分析,發(fā)現與SFP小鼠相比,GF小鼠大腦中的C/EBPβ/AEP信號傳導減弱,作為記憶障礙導致AD發(fā)病和炎癥核心網絡的花生四烯酸(AA)代謝途徑相關的Lox5、Cox1和Cox2水平明顯降低(圖2 A、B)。蛋白酶測定顯示GF小鼠的AEP酶活性低于SPF小鼠,這與活性AEP水平降低保持一致(圖2 C)。GF小鼠中IL-6濃度(C/EBPβ是其主要轉錄因子)顯著降低(圖2 D)。qPCR結果顯示,GF小鼠的CEBPβ靶點/AA通路基因表達下降(圖2 E),與RNAseq數據趨勢一致。上述結果表明,復雜的腸道菌群促進AD小鼠模型的病理過程。
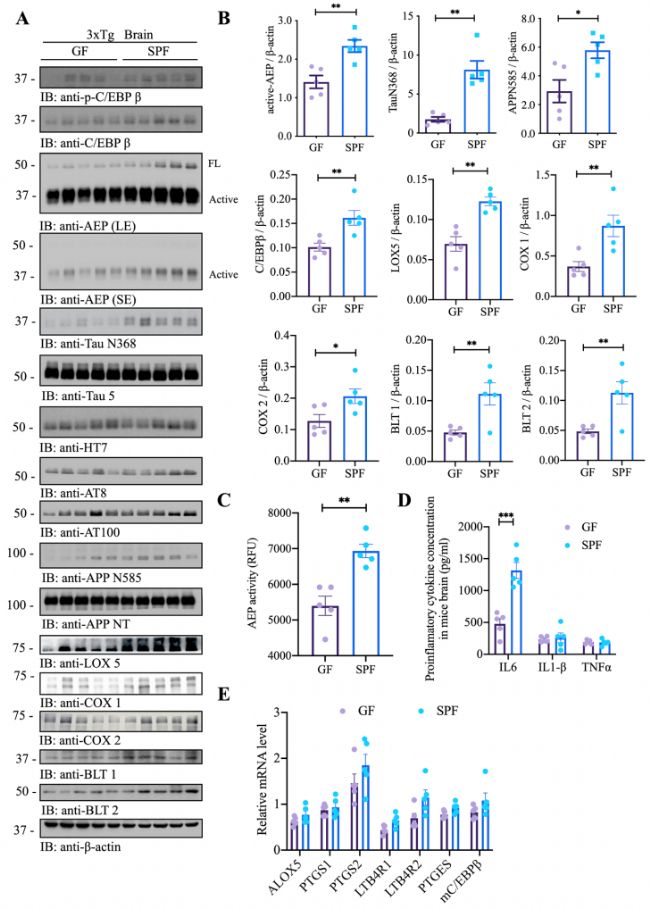
圖2 無菌小鼠表現出減弱的C/EBPβ/AEP通路和AA相關炎癥
3. 腸道菌群提高炎癥代謝物水平,并改變大腦中的炎癥和胰島素/IGF-1途徑
為了評估腸道微生物組對AD相關轉錄反應的整體影響,作者對GF和SPF小鼠海馬樣本轉錄組測序,結果顯示兩者整體基因表達模式存在顯著差異,與GF小鼠相比,參與AA代謝途徑的基因在SPF小鼠中差異表達(上調:Hpgd、Ptges3和Cyp1b1;下調:Ptges2),這與上述的觀測結果相符(圖3 A-D)。此外,SPF小鼠的胰島素信號傳導及其相關的下游途徑發(fā)生了異常改變,免疫印跡實驗也證明了這一結果(圖3 E、F)。這些結果表明,腸道菌群影響AD小鼠海馬區(qū)基因的表達。
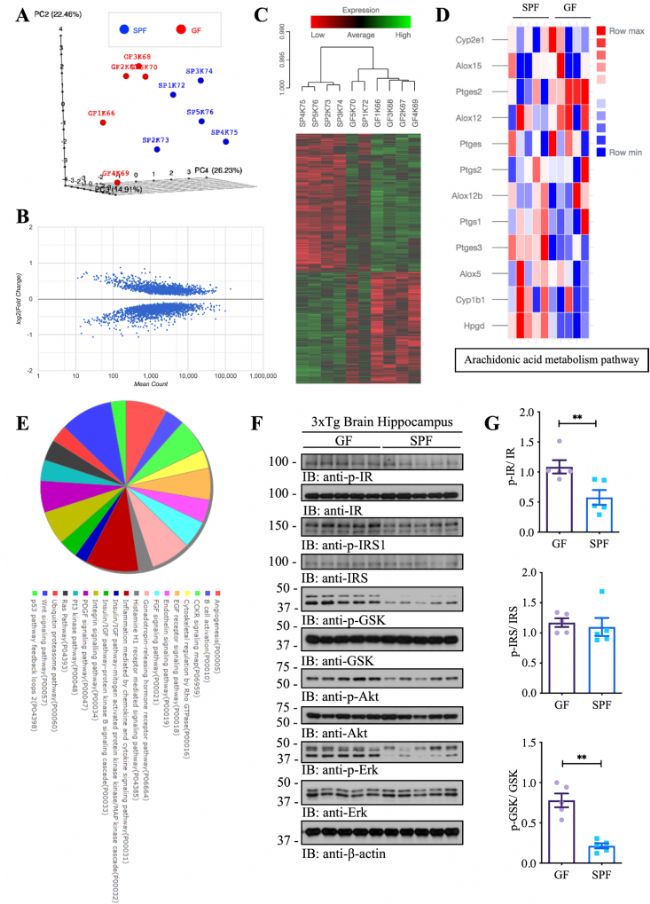
圖3 腸道菌群影響AD小鼠模型海馬區(qū)mRNA表達的轉錄組圖譜
4. SCFAs可引起GF小鼠C/EBPβ/AEP激活、認知障礙和炎癥反應,并被PGE2-G促進
前期研究表明SCFAs與AD相關,GF小鼠糞便和血清中SCFAs水平降低。為了研究SCFAs是否會部分模擬定殖SPF小鼠的腸道菌群觸發(fā)C/EBPβ/AEP通路激活,作者設置了GF小鼠SCFAs補充飼喂實驗。結果表明,相比對照GF小鼠,補充SCFAs小鼠中C/EBPβ下游靶標、AEP蛋白酶活性、IL-6和Aβ42水平顯著增加,認知緩解水平降低(圖4 A-H)。代謝組分析結果顯示,與SPF相比,GF小鼠糞便中的PUFA代謝物顯著減少,同時補充SCFAs和PGE2-G(代謝組分析鑒定出的標志物)刺激小膠質細胞形態(tài)的成熟和活化(圖4 J-L)。這些結果表明SCFAs可引起GF小鼠C/EBPβ/AEP激活、認知障礙和炎癥反應,并被PGE2-G促進。
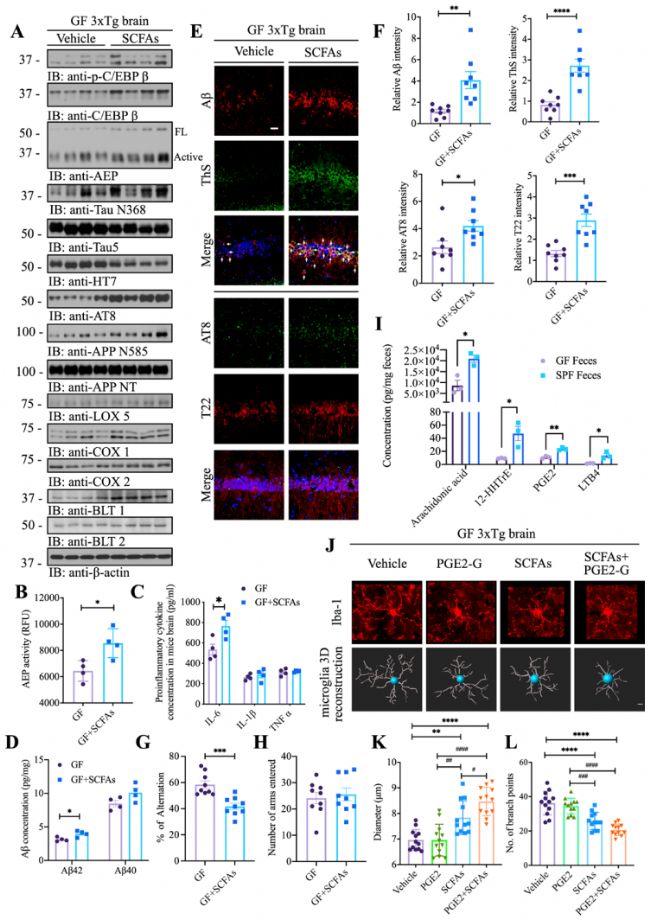
圖4 SCFAs引發(fā)無菌小鼠炎癥反應中C/EBPβ/AEP的激活和認知缺陷,PGE2-G能加劇這些反應
5. FMT后受體小鼠腸道特定菌群增加,增強AD病理,促進認知障礙
為了確定人源性腸道菌群在轉移到GF小鼠時是否會影響疾病結果,作者分別將AD患者和健康人(HC)糞便移植給GF小鼠。結果顯示受體小鼠腸道菌群和供體相似,AD受體小鼠中擬桿菌屬的3個種相對豐度顯著增加(圖5 A-E),體外定量實驗表明,這3種微生物參與AA代謝,并產生AA衍生物(圖5 I)。免疫熒光(IF)實驗結果顯示,受體小鼠ThS陽性Aβ聚集體、AT8/T22和Aβ42增加(圖6 A-C)。與HC小鼠相比,AD受體小鼠在Y迷宮中表現出認知缺陷,小膠質細胞高度活化且形態(tài)成熟(圖6 D-K)。這些結果表明AD患者腸道菌群會促進GF受體小鼠AD進程。
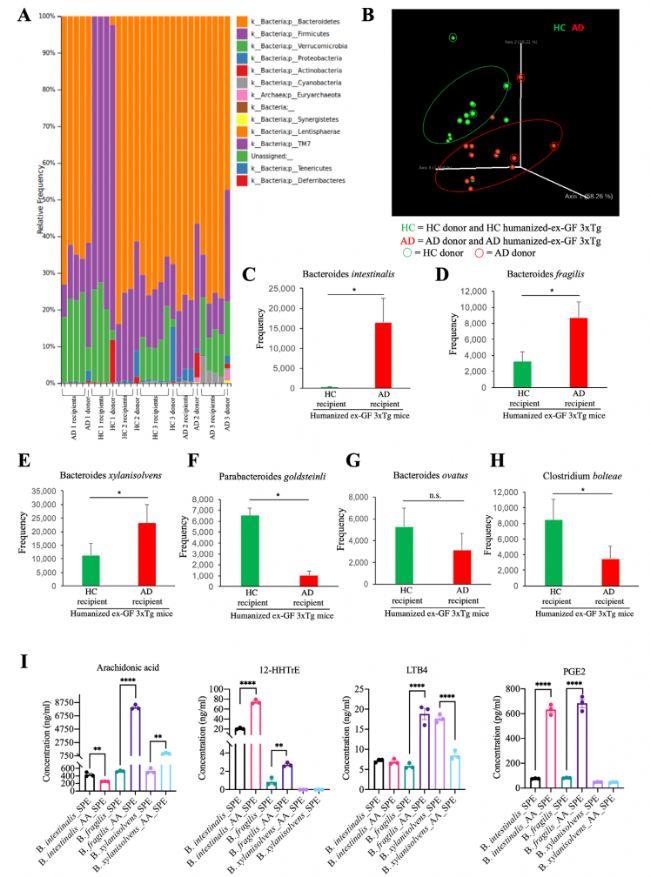
圖5 移植AD患者糞菌后的無菌小鼠腸道擬桿菌屬相對豐度升高
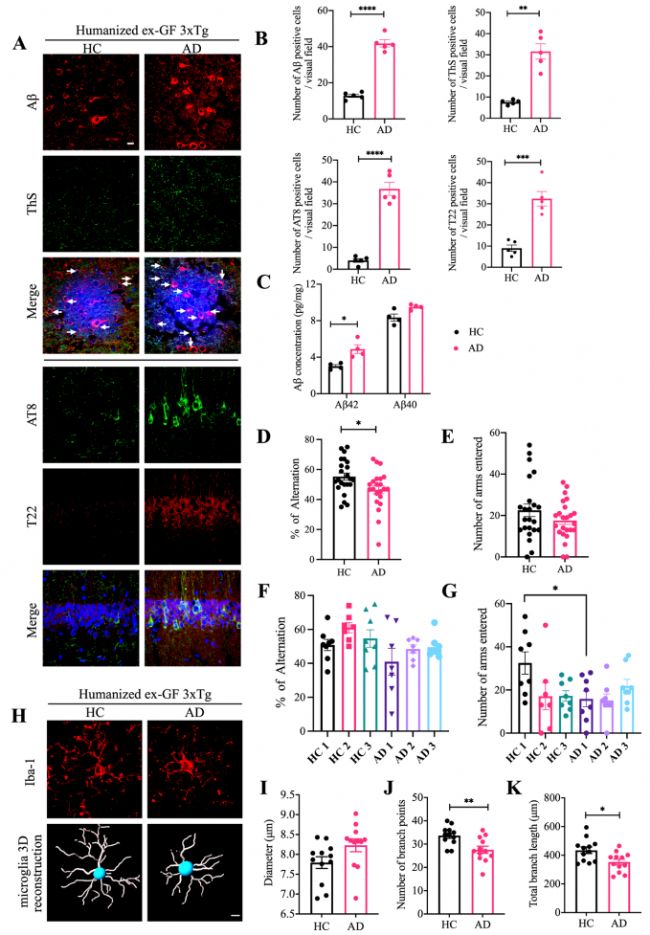
圖6 移植AD患者糞菌后的無菌小鼠表現出增強的AD病理和認知缺陷
6. FMT后受體小鼠C/EBPβ/AEP通路激活且與炎癥水平升高相關
免疫印跡結果顯示p-C/EBPβ及其總蛋白、AEP及其上游轉錄因子、C/EBPβ及其下游響應基因水平均顯著增加(圖7 A-C)。炎性細胞因子定量和qPCR實驗結果顯示,AD受體小鼠中IL-6和IL-1β、ALOX-5相關基因表達水平顯著增加(圖7 D、E)。
免疫印跡結果顯示p-C/EBPβ及其總蛋白、AEP及其上游轉錄因子、C/EBPβ及其下游響應基因水平均顯著增加(圖7 A-C)。炎性細胞因子定量和qPCR實驗結果顯示,AD受體小鼠中IL-6和IL-1β、ALOX-5相關基因表達水平顯著增加(圖7 D、E)。
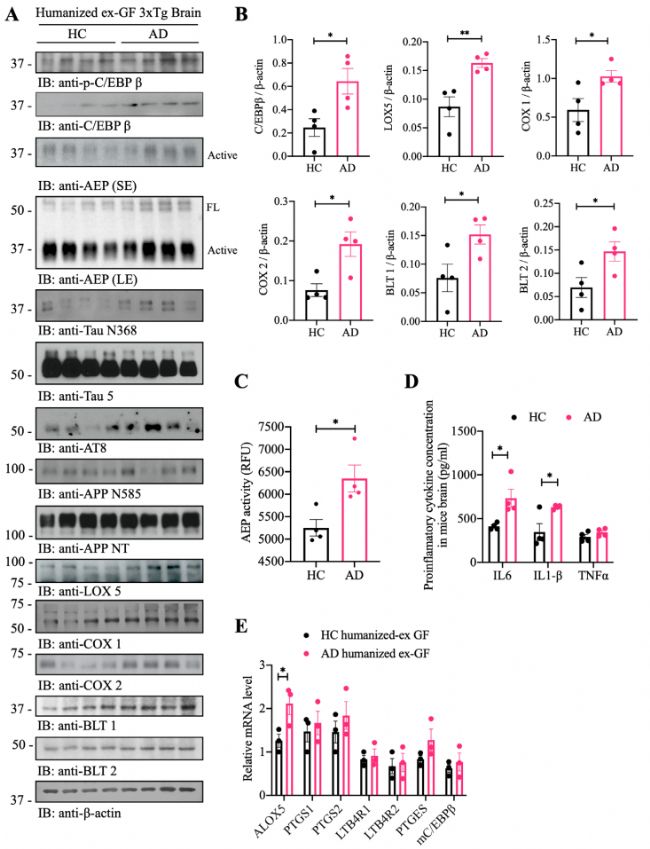
圖7 移植AD患者糞菌后的無菌小鼠小鼠表現出C/EBPβ/AEP通路激活且與炎癥水平升高相關
小編小結
本文的研究結果表明,人類微生物組可能是阿爾茨海默病的危險因素。通過個性化飲食、有益微生物群干預以及糞菌移植來調節(jié)腸道微生物群或可有助于減少炎癥和治療包括AD在內的腦部疾病。
中科優(yōu)品推薦
【中科新生命】全面推出腸道微生物群-免疫系統(tǒng)多組學解決方案,多角度、多層次、全方位深入挖掘腸道菌群和免疫系統(tǒng)之間的關聯性,并結合表型結果,擬幫助科研人員開發(fā)一種新型干預性措施的潛在靶點。
腸-免疫-靶軸系統(tǒng)研究方案
· 16s/宏基因組----腸道微生物的組成及改變
· 免疫代謝組----腸道微生物產生的用于調控機體免疫的代謝物
· 免疫因子組----腸道微生物如何影響機體免疫
· 轉錄/蛋白質組----對終端靶器官應對炎癥響應機制的系統(tǒng)描述
【中科新生命】全面推出腸道微生物群-免疫系統(tǒng)多組學解決方案,多角度、多層次、全方位深入挖掘腸道菌群和免疫系統(tǒng)之間的關聯性,并結合表型結果,擬幫助科研人員開發(fā)一種新型干預性措施的潛在靶點。
腸-免疫-靶軸系統(tǒng)研究方案
· 16s/宏基因組----腸道微生物的組成及改變
· 免疫代謝組----腸道微生物產生的用于調控機體免疫的代謝物
· 免疫因子組----腸道微生物如何影響機體免疫
· 轉錄/蛋白質組----對終端靶器官應對炎癥響應機制的系統(tǒng)描述
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






