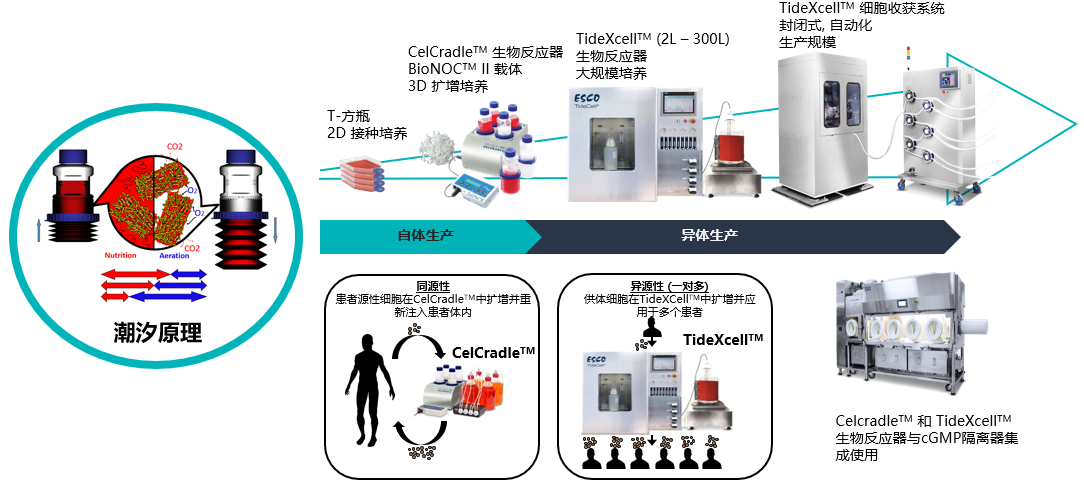
三維潮汐式生物反應器于間充質干細胞的應用
前 言
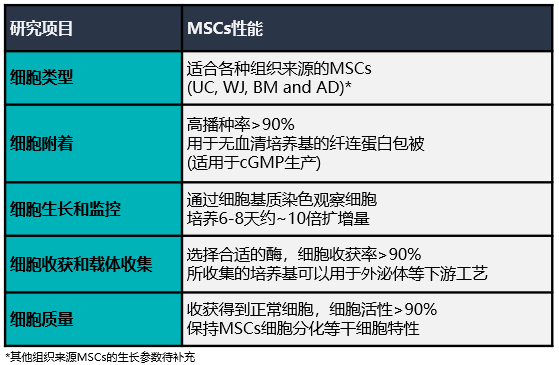
未來的細胞治療需要大量的間充質干細胞(MSCs),每個劑量從1000萬到2億多個細胞不等。當需要超過5000萬個細胞的大劑量使用時,傳統的平板培養是不切實際的。而利用生物反應器并結合線性放大、過程控制和自動化,是解決這一需求的主要方法。然而許多生物反應器在MSCs培養方面都面臨技術難題,比如如何控制培養基充分混合的同時將剪切力最小化,以及如何從具有高產量和高活性的片狀載體中分離得到細胞等諸多難點。
潮汐式生物反應器,利用3D片狀載體(BioNOC II)建立了一個強大的、可擴展的平臺,以滿足未來臨床治療的需求。在整個培養期間,監測細胞培養條件,并測量生長過程參數,如葡萄糖消耗量和pH值,以確保適當的放大。同時研究優化干細胞培養系統所需的細胞接種密度、培養基培養條件和改進的生物工藝參數等關鍵問題。總的來說,Esco將提供過程優化與質量控制以及放大生產過程中的相關標準,以便協助用戶將學術或工業研發轉化為面向未來的臨床試驗和商業化銷售。

各組織來源MSCs的生長情況
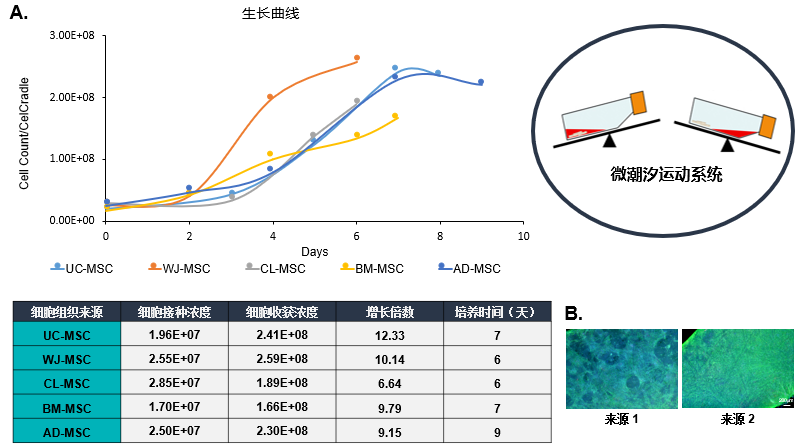
(A)用潮汐式生物反應器系統成功擴增了不同組織來源的MSCs。MSCs的常見組織來源,如臍帶間充質干細胞(UC-MSC)、沃頓膠間充質干細胞(WJ-MSC)、骨髓間充質干細胞(BM-MSC)和脂肪間充質干細胞(AD-MSC),在培養后7天內普遍可擴增10倍。上表列出了使用商業細胞來源進行優化的不同組織來源MSCs的接種密度。
(B)將同類型(相同組織來源)但細胞來源不同的MSCs,從低播種密度進行擴增能力測試。結果顯示,來源2的BM-MSCs與來源1的BM-MSCs生長情況存在明顯差異,因此在進行線性放大擴增之前,需要對每個來源MSCs進行播種密度、培養基變化規律等參數進行優化。
MSCs在不同培養基中的擴增情況
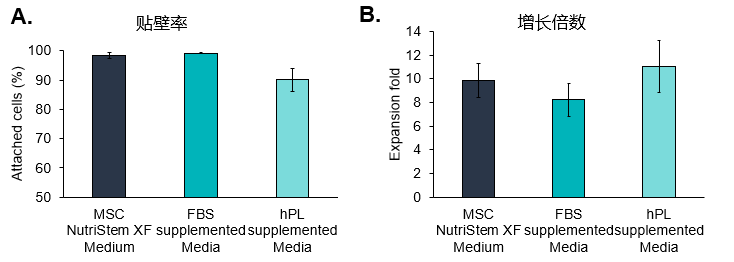
(A) 將UC-MSCs接種于含血清代替物(hPL)的培養基中,觀察到其對載體的貼壁效率較低。
(B) 盡管觀察到的附著效率較低,但使用血清代替物補充培養基,使不同組織來源MSCs的細胞擴增倍數增大。
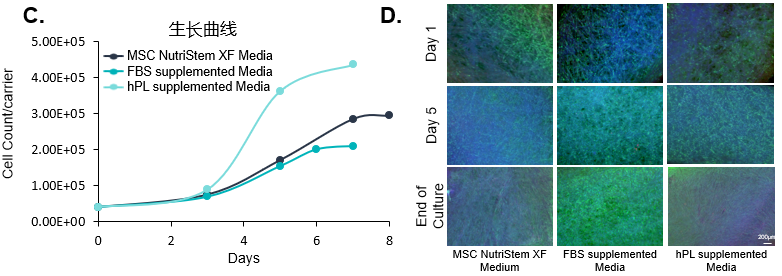
(C) 在將UC-MSCs接種到BioNOC II載體之前,對不同培養基類型培養的細胞進行2次以上傳代,以監測其增殖速率。結果顯示含血清代替物(hPL)培養基培養的細胞增長最快。
(D) 熒光圖像顯示細胞在培養期間在載體上的擴增情況,結果顯示含胎牛血清(FBS)培養基的細胞生長較好,含血清代替物(hPL)的次之。綜合考量,使用含血清代替物培養基是更優的選擇。
綠色:熒光素二乙酸酯(活細胞細胞質)
藍色:Hoechst 33342(細胞核)
紅色:碘化丙啶(死細胞)
細胞收集工藝優化
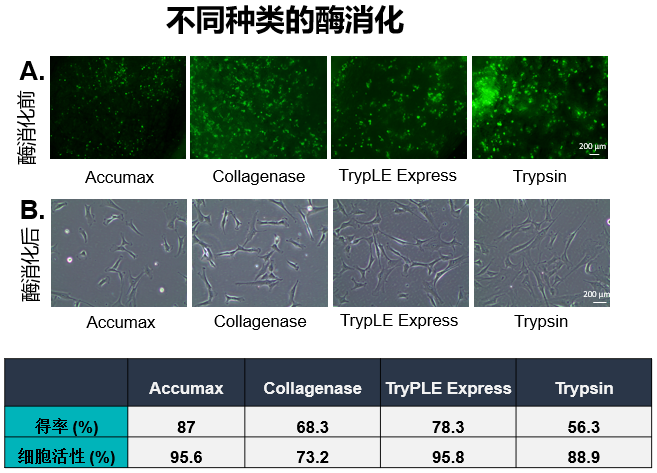
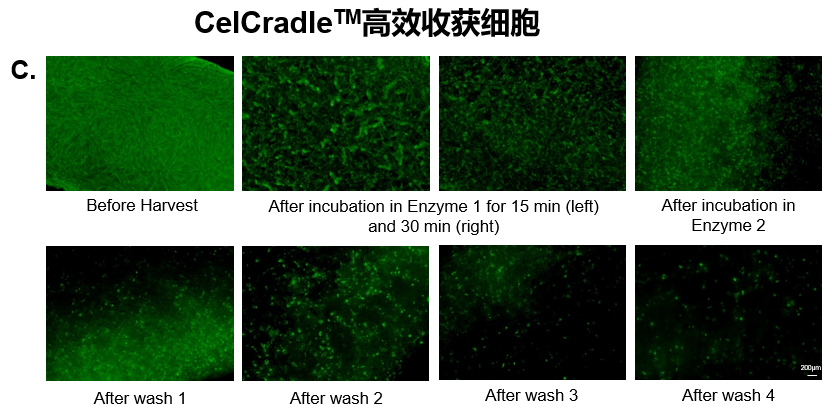
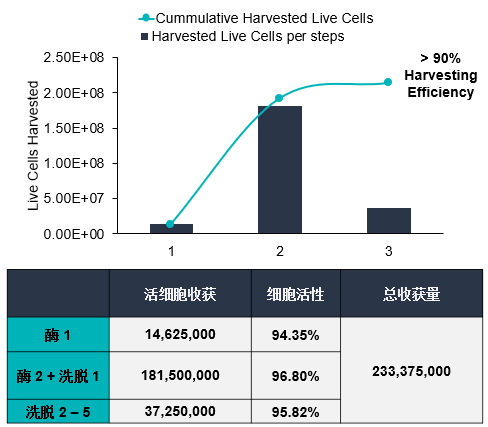
通過優化參數,開發了一種從BioNOC II載體高效收獲UC-MSCs的方法。在整個實驗過程中,使用熒光素二乙酸酯(FDA)對BioNOC II載體上的活細胞進行染色。
質量控制
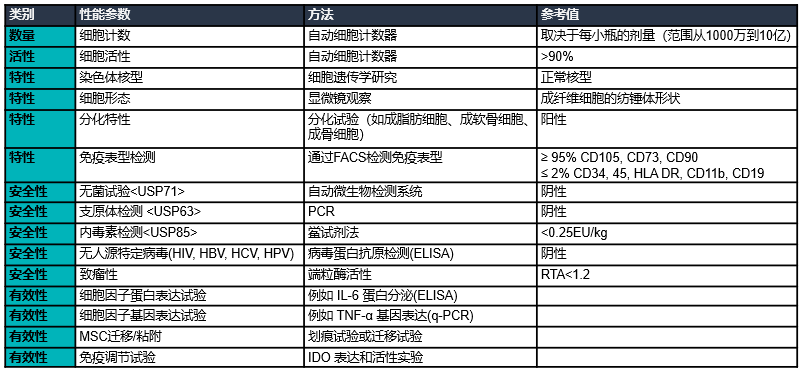
結 論
*潮汐式生物反應器是由無菌一次性CelCradle細胞培養瓶和波紋管壓縮平臺組成,可線性放大,且在培養過程中支持取樣監測。
*小規模系統支持MSCs早期研發階段,可以低成本高效率進行參數優化。
*為大批量生產MSCs提供一個很好的平臺。