吉凱基因Dr.L的私家實驗筆記——穩定株
1、什么是瞬時表達和穩定表達?
課前熱身,了解的同學請直接進入題2
瞬時表達:外源片段不能隨細胞分裂而一同復制,導致表達時間短暫,且表達量隨時間逐漸下降。
穩定表達:是指外源片段整合入細胞基因組中,并能隨細胞分裂穩定傳遞下去,表達量長時間處于穩定水平。
那穩定株,顧名思義當然是屬于穩定表達的體系了。
2、我的實驗是否需要篩選穩定株?
能夠達到穩定表達的方法不止穩定株一種哦。我們使用慢病毒感染細胞,也一樣可以達到穩定表達的效果。什么原理呢?
*慢病毒是整合型的逆轉錄病毒載體,感染細胞后,攜帶的外源片段會直接整合入細胞的基因組DNA中,并能夠隨細胞分裂穩定傳代。所以對于大多數實驗,包括細胞周期、凋亡、增殖等功能學實驗,甚至裸鼠成瘤等長時間的實驗,只要細胞感染效率較高(70%~80%以上),感染一次慢病毒就可以達到長時間、高效的基因操作的目的,滿足實驗要求,無須篩選穩定細胞株。
3、細胞感染效率較高(70%~80%以上),臣妾做不到啊,難感染的細胞怎么辦?
少年,恭喜你選擇了hard模式。那就趕緊召喚穩定株吧。那么問題來了,選擇何種方式將外源片段整合入細胞基因組中呢?
質粒(常規轉染/電轉):這種方法介導的整合幾率和中500w彩票差不多哦😱(<<10-6),且整合進入的片段大小是隨機的,常常不是丟了西瓜(目的基因)就是少了芝麻(抗性基因),導致假陽/陰性率高。
慢病毒:攜帶的外源片段在病毒重組酶的作用下直接整合入細胞的基因組DNA中,因此效率與質粒相比要高多個數量級。而且整合片段是固定的,目的基因和抗性基因終于可以手牽手一起走啦。
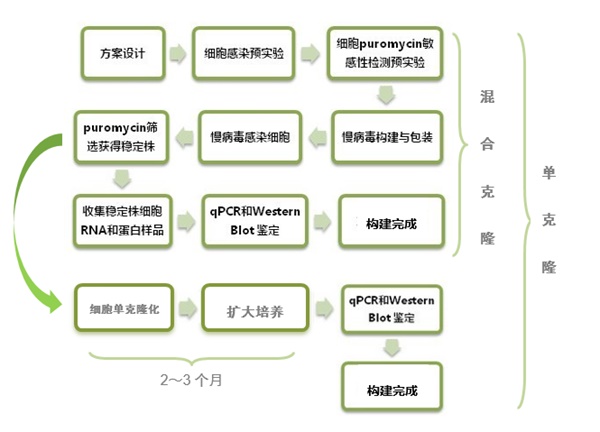
下面幫大家整理了利用抗性基因進行篩選的標準流程。
*藥篩法關鍵在于藥物作用濃度和時間的確定,這點根據細胞的不同需要經過預實驗,還要保證在篩選出穩定株的同時藥物不會對細胞的狀態產生不良影響。
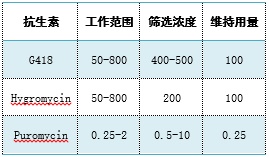
➢常用抗性篩選標志物:新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin),常用G418來代替新霉素進行選擇性篩選。
篩選抗生素的推薦使用濃度(μg/ml)
💣此處有坑請注意:大部分細胞株是群居“動物”,需要同類的陪伴才能正常生長哦,若是不幸落單,則生長緩慢或者索性不長,再努力也拿不到單克隆株呢。
4、那么問題來了,同樣是穩定株,單克隆?混合克隆?傻傻分不清楚~要怎么選?
單克隆穩定株:來源于含有穩定整合外源片段的單個細胞的擴增。
混合穩定株:由多個單克隆穩定株混合構成的克隆群,不同的單克隆其外源片段的整合位點不一樣。
由于不同細胞基因組背景存在差異,且不同整合位點的單克隆細胞株表現出來的細胞表型可能不一致,所以使用混合克隆株更能去除細胞間差異造成的干擾,否則需要對多個單克隆穩定株進行比較,才能獲得更精確的實驗數據。
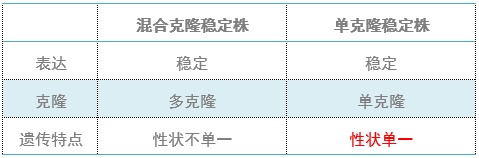
為了去除細胞間差異,得到更精確的實驗結果,我們推薦您使用慢病毒感染,或者構建混合克隆穩定株!
● 感染效率70%~80%以上即可直接實驗,不會受到質疑
● 高分低分文獻都使用混合克隆,國際承認
● 篩選單克隆株至少要用兩株細胞來去除細胞間差異,工作量翻倍,不劃算
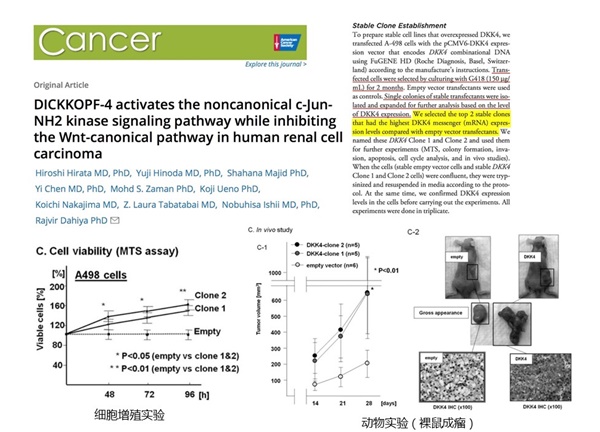
比如下面這篇5分文章,花了2個月構建穩定株,再吭哧吭哧把細胞功能學、動物實驗都做了兩遍。不但要保證兩個單克隆株目的基因表達量一致,功能實驗結果也要類似哦!要是不一致怎么辦?換一株再重復呀,真是給自己挖了一大坑!
5、穩定株構建不出來,怎么辦?可誘導表達的穩定株:TET-on慢病毒系統
下面兩種情況,常規的穩定株構建式比較困難的,但是辦法總比困難多
1)過表達:看基因功能。如果是抑制腫瘤細胞的增殖或促進腫瘤細胞的凋亡,那么是很難構建穩定株的(目的基因感染細胞后就會凋亡或不長)。
2)干擾:建議構建可誘導表達的穩定株。RNA 干擾敲減的是細胞內源在用的基因,敲減后,短時間內會看到抑制效果,但時間長了后,細胞內會有調控機制將被抑制的基因上調表達,甚至超過常規的量。
這兩種情況下,建議病毒感染細胞后直接做功能實驗或進行裸鼠成瘤實驗。如果要做穩定株需要用TET-on慢病毒系統。
那什么是TET-on系統?具體如何使用呢?
我們下期見!






