祝賀第六屆百奧賽圖動物與醫藥產業大會圓滿落幕
如果把近代醫學比作人類文明發展的皇冠,那么不斷涌現的創新療法和技術平臺可謂是皇冠上一顆顆璀璨的明珠。以細胞基因治療、雙特異抗體、ADC、PDC、RNA、單細胞技術、人工智能AI及全人抗體人源化小鼠等為代表的治療手段和技術平臺的發展正在為患者帶來新的希望。
2020年6月13日,位于素有“江海門戶”之稱的海門市,一場論道“技術創新驅動新藥研發”的行業盛事正在這里召開。一年一度的百奧賽圖模式動物與醫藥產業大會已經走到了第六個年頭,在疫情余震的情況下仍能匯聚800余位來自學術、產業、投資界的一線專家學者實屬難得。本次大會由百奧賽圖和海門科技園共同主辦,同寫意、愷思俱樂部及ACROBiosystems作為協辦單位支持。


百奧賽圖創始人沈月雷博士
*以下報告內容未經大會報告專家確認,觀點準確性以現場分享為準。
近年來“細胞與基因治療”的開發熱潮不減,繼小分子藥物和抗體藥物之后的第三大藥物,細胞與基因治療在罕見病、腫瘤等疾病治療領域均有創新突破。隨著2017年Yescarta和Kymriah兩個細胞藥物的上市,細胞成為藥物,技術已經不再是難題。
會上,中國科學院腦科學家與智能技術卓越創新中心/神經科學研究所楊輝研究員介紹,基因治療分為兩類:一類為基因改造細胞療法,例如CAR-T、TCR技術、HSC技術;另一類便是基因替換、基因編輯技術,例如CRISPR技術。
技術的成熟和20多年歷史的積累使細胞和基因治療行業進入了爆發期,但這仍是開始階段,有許多技術難題需要攻克。正如楊輝博士談到,基因編輯應用于臨床的最大瓶頸便是脫靶問題,這會影響細胞正常功能,增加致癌風險。
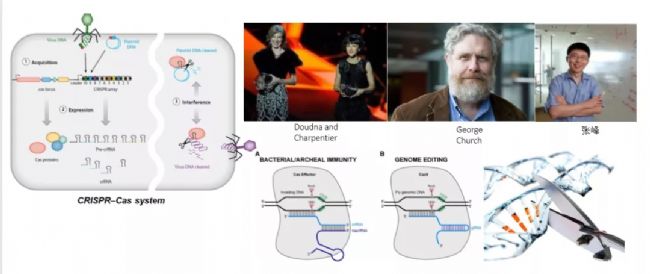
基因編輯和基因治療簡單來說可以視為一個手段或工具,在多種疾病領域均有應用,以眼科遺傳疾病為例,中國科學院神經科學研究所高級研究員仇子龍博士談到其團隊開發了一種高效的基于HDR的Cas9 / RecA系統,可在出生后的視覺退化小鼠(rd1)中以HDR效率更高的方式正確糾正Pde6b突變,該模型小鼠是一種以光感受器變性和視力喪失為特征的色素性視網膜炎(RP)突變模型,為RP和其他遺傳疾病提供了一種新的精準治療方法。
核酸藥物作為基因治療的一種形式,也是本次大會討論的一大熱點,國內外在研藥物以反義核酸(ASO)、小干擾RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)、適配體(aptamer)、核酶(ribozyme)和抗體核酸偶聯藥物(ARC)等代表。圣諾生物醫藥CEO陸陽博士線上分享了增強免疫檢查點抑制劑抗腫瘤活性的siRNA治療進展。艾博生物英博博士也在大會中介紹mRNA在腫瘤免疫及傳染病疫苗中的應用。
2020年5月,Nature Reviews Drug Discovery上刊文對全球細胞療法進行深度盤點,目前全球細胞療法上市或在研項目多達1483種,CAR-T 療法獨占鰲頭。盡管CAR-T療法在血液瘤的研究相對成熟,但市場上對CAR-T主要的擔憂在于其靶點較少(多集中于CD19、BCMA)、自體為主、適應癥仍較少及實體瘤難以攻克的挑戰上。
面對CAR-T發展的行業痛點,亙喜生物副總裁兼研發負責人沈連軍博士介紹道,亙喜生物已經開發出FasT CAR-T技術和TruUCAR-T技術。FasT CAR-T技術可以在一天生產出CAR-T細胞,而TruUCAR-T技術則是從健康的供者獲得的T細胞制作成百上千個劑量的CAR-T細胞,此外團隊也在關注CAR-T治療實體瘤方面的動態。
實體腫瘤是細胞治療最想解決的領域,目前的技術方案,包括CAR-T、TCR-T、溶瘤病毒、腫瘤的疫苗等。廣州香雪精準醫療技術有限公司李懿博士指出,TCR-T和CAR-T同屬過繼T細胞療法,CAR-T細胞療法是通過識別膜表面抗原而發揮作用,而對于近乎九成的惡性實體腫瘤缺乏膜表面特異性靶標,TCR-T細胞則能夠識別細胞內來源的腫瘤特異性抗原。在研項目靶向NY-ESO-1的TCR-T細胞已在國內外治療多種癌癥臨床試驗中,展示出良好的安全性和有效性,是目前最有可能在實體瘤取得突破的T細胞免疫療法。
不得不說,如今中國的細胞基因治療已經行駛在了發展的高速路上。中國科學院生物化學與細胞生物學研究所曾藝老師、上海益諾思總經理常艷博士、濱會生物董事長劉濱磊博士依次分享了其團隊在成體干細胞領域、細胞治療產品的非臨床評價、溶瘤II型單純皰疹病毒臨床階段的研究進展和經驗。


群雄逐鹿,雙抗、ADC新型抗體藥物開發
截至2019年底,FDA累計批準抗體藥物達到87款。近年來,隨著熱門靶點的同質化競爭進入白熱化階段。國內外大小制藥和生物技術公司都爭相布局新一代工程抗體產品,比如雙/多特異抗體、ADC、納米抗體等。
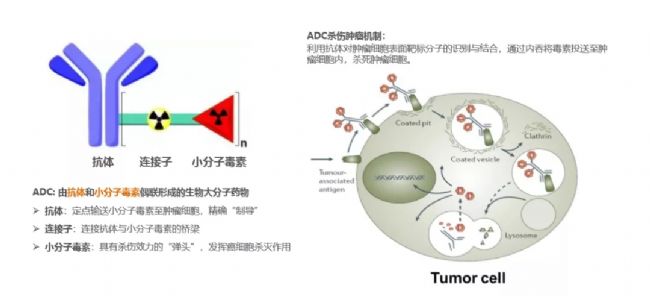
目前全球共有8個ADC藥物獲批上市,自首個ADC藥物Mylotarg上市以來,ADC藥物也歷經了三代技術革新。四川科倫博泰生物醫藥股份有限公司副總裁肖亮博士分析了國內外ADC藥物整體研發進展及策略,介紹科倫博泰自主研發的ADC藥物A166和A264項目也在前期取得了不錯的試驗進展。
啟德醫藥董事長兼總裁秦剛博士談到當前ADC藥物研發面臨著異質性問題,Linker不穩定,工藝放大難、產率低三大難題。啟德醫藥借助連接酶定點偶聯技術(LDC)和智能連續偶聯平臺(iLDC)以及打造一體化的生產工藝,自主研發的新一代ADC藥物GQ1001具有良好的腫瘤靶向性,能夠快速富集到腫瘤組織中,臨床開發風險高度可控,有望成為HER2靶向治療best-in-class藥物。
在國內ADC藥物研發第一梯隊,榮昌生物是重要的存在,旗下自主研發的RC48是我國第一個進入臨床研究的ADC藥物。此次大會上,榮昌生物制藥有限公司總裁傅道田博士談到,隨著市場對創新藥需求的增加,注冊法規改革,一系列小型研發公司的崛起和競爭加劇,推進臨床的速度直接決定了項目的成敗。而在生物藥開發和產業化的過程中CMC 成為關鍵的考慮點。
近年來,雙特異性抗體有一個明顯的井噴趨勢,雙抗體開發思路主要集中在招募免疫細胞、阻斷信號通路和遞送毒性藥物等方面。會上普米斯生物功能生物學和細胞治療總監李志遠博士著重分享雙特異性抗體細胞遞送系統的開發和應用。

創新技術推動著生物醫藥行業的一次次變革,技術平臺在新藥開發的應用也是關乎成敗的重要一環。
如何借助技術創新更好的開發新藥是本次大會的一大主題。會上百奧賽圖抗體開發部總監陳磊博士談到,百奧賽圖的RenMab替換了人抗體重鏈基因所有VDJ區域和kappa輕鏈所有VJ區域,是全世界迄今替換最全的抗體人源化小鼠,具有最完整的抗體多樣性,也更容易獲得好的抗體。詳細分享了在新冠疫情期間,如何借助RenMab平臺進行治療性中和抗體開發的案例。金斯瑞生物藥發現部執行總監殷劉松博士、澳斯康總裁羅順博士也分別站在抗體開發平臺及生物藥規模化生產方面展開了經驗分享。
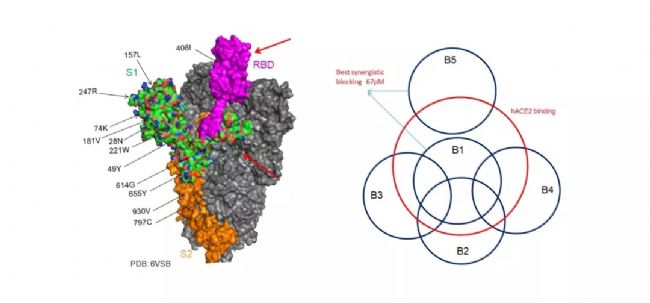
新冠病毒中和抗體表位多樣性
眾所周知,一款新藥的平均研發投入是26億美元,然而當前新藥的臨床失敗率高達92%。人工智能的加入會是提高新藥研發成功率的轉折點嗎?如今,全球人工智能藥物研發公司已經遍布全球,Top200的人工智能新藥研發公司仍以美國最多,占據一半以上,而我國僅為3%。
會上,晶泰科技總裁溫書豪博士談到,其實人工智能技術已經融入新藥研發的各個環節,從機理研究、新藥設計、臨床前研究、臨床研究、FDA審核到最終上市均有應用。來自深圳智藥的創始人金鋒博士對于基于深度學習的新藥發現技術平臺也十分吸睛。


愷佧生物CTO ManHee Suh博士、中美冠科副總裁王簾讀博士、Berkeley Lights 亞太區產品經理楊月紅女士、近岸蛋白董事長朱化星博士及高濟生物執行總監周禾博士也依次介紹了旗下產品或平臺在藥物發現與開發階段的關鍵應用。




投資人與科學家對話沙龍
會場花絮

展區風采
第六屆百奧賽圖模式動物與醫藥產業大會不知不覺已走過6個年頭,六年里經過不斷探索與發展、秉承交流合作的理念,展區規模不斷擴大,吸引了很多生物產業的企業參展,類別主要涵蓋分子生物學儀器、基因診斷類、實驗室常用儀器、服務提供商等。

為讓參會者對參展企業有更深入的了解,我們特別組織“網紅打卡”、“抓彩球”及“扔飛鏢”等展區活動,讓我們一睹展商們的風采吧~





- 上海溪拓亮相首屆上海復雜體系超快動力學會議
- 2025BPD第八屆生物藥工藝發展大會抗體日程首次公布
- 勤翔IVScope 8000Pro小動物活體成像系統閃耀三展會
- 第五屆多組學科研與臨床應用大會五一福利大放送
- ATMP 2025第九屆先進療法創新峰會通知
- NGDx2025第十屆先進診斷技術開發與應用論壇通知
- CBPT2025第13屆生物制藥分離純化技術創新論壇通知
- 第45屆西部國際醫療器械展覽會通知
- 易科泰應邀參加第十屆全國生態毒理學大會
- 世平搖床亮相第六屆BIONNOVA生物醫藥創新者論壇
- 百林科亮相CBioPC并發布《抗體生物工藝及應用實例》
- 艾貝泰攜生物反應器等亮相第二十四屆生物制品大會
- 2025BPD第八屆生物藥工藝發展大會內容亮點公開
- 洛科儀器誠摯邀您參加2025環境分析研討會
- 安捷倫在AACR 2025展示開創性解決方案與合作成果
- 南模生物將攜多個動物模型最新研究成果亮相AACR年會
- 南模生物邀您相約華東第17屆實驗動物科學學術交流會
- 南模生物大/小鼠實驗操作線下培訓班第二輪報名通知
- 南模生物邀您相約第二屆自免藥物及療法論壇
- 高品質實驗爪蟾上新!北京海威磐石獲準進口非洲爪蟾
- 賽業直播:從退行性疾病小鼠模型到新型AAV遞送突破
- 南模講座預告:誘導多能干細胞(iPSC)技術及應用前景
- 賽業講座:免疫重建小鼠在腫瘤免疫治療研究中的應用
- 南模直播預告:抗體藥物偶聯物(ADCs)的最新進展
- 南模直播預告:B細胞相關自免與炎癥疾病模型的構建
- 南模今晚直播:人源化自免小鼠模型構建及其應用前景
- 李勁松院士做客南模生物直播間,講述基因組標簽計劃
- 講座:人免疫系統重建小鼠在腫瘤免疫治療研究中應用
- 不同以“網”,智驅未來,賽業生物官網煥新升級
- 南模生物邀您相約第十六屆全國免疫學學術大會






