二聚體菁染料分子間和分子內的協同聚集提供了體內自我遞送和光熱治療

近日,彭孝軍院士團隊研究成果在《advanced functional materials》上發表,文章標題為“Synergistic Inter- and Intramolecular Aggregation of Dimeric Cyanine Dyes Affords Highly Efficient In Vivo Self-Delivery and Photothermal Therapy”。該研究詳細地描述了一種新型的光熱療法策略,從分子設計到體內外的實驗驗證,展示了其在抗癌治療中的潛力。
光熱療法作為一種有前途的抗癌治療策略,依賴于開發具有強大體內傳遞能力和治療效果的光熱劑(Photothermal Agents, PTAs)。然而,目前缺乏有效的分子設計方法來實現高性能的PTAs。
該研究提出了一種策略性設計的二聚七甲基菁(Cy7)分子,通過鄰位/間位/對位-苯基二硫醇共價連接,這些設計促進了在水中自發的納米粒子組裝,這歸因于有效的分子間聚集,增強了體內傳遞。此外,分子內Cy7單元之間的聚集促進了優越的光熱轉換效率(PCE),對于間位二聚體可高達74.1%。值得注意的是,對位二聚體變體不僅實現了高達61.1%的高PCE,而且還展示了最有效的藥代動力學特性,導致體內無與倫比的抗癌效果。這種雙重聚集策略,利用分子間和分子內的動態,為二聚體Cy7提供了卓越的自我傳遞能力和光熱效果,為下一代光熱療法提供了一種有希望的方法。
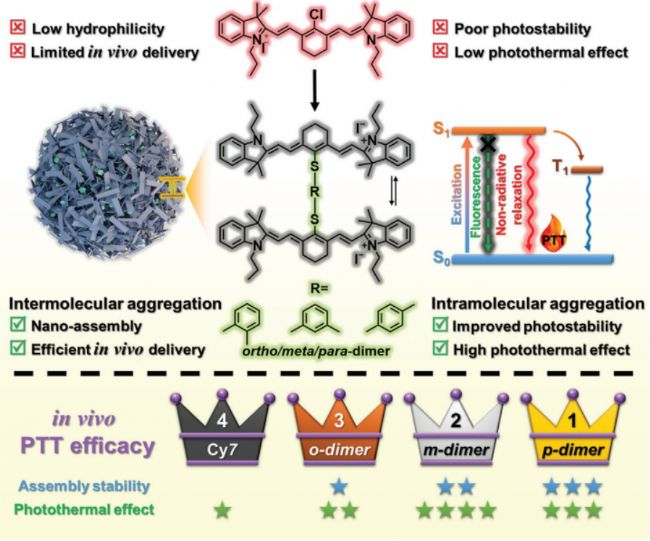
文中研究單體與二聚體分散在水中時的行為,使用動態光散射(DLS)和透射電子顯微鏡(TEM)對水分散的二聚體進行進一步表征。研究結果表明二聚體Cy7自發地組裝成平均直徑約為100納米的球形結構,并且在模擬生理條件下(10%FBS的細胞培養基)也具有穩定性。
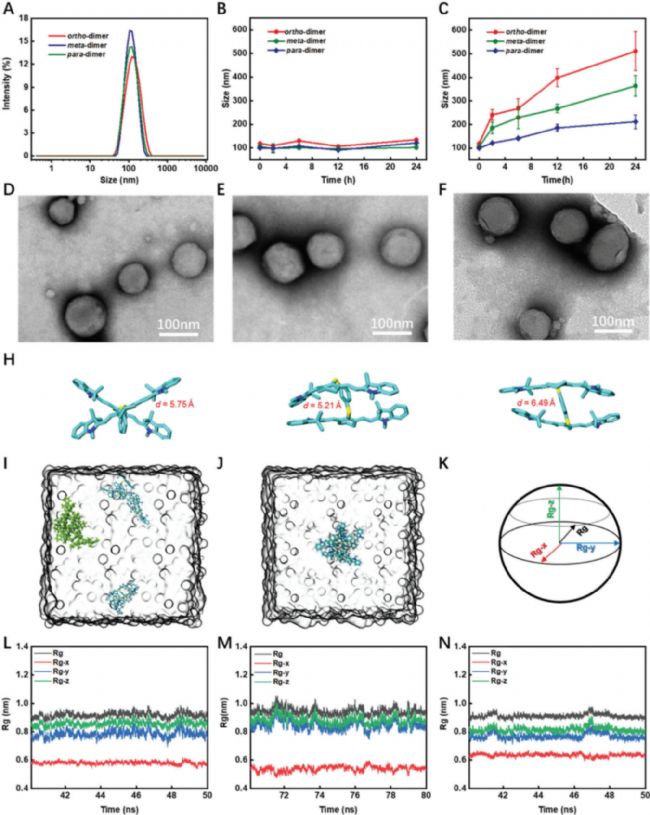
實驗結果表示,二聚體Cy7的熒光量子產率為Φf < 0.3%,較單體顯著降低;二聚體Cy7的熒光猝滅主要是通過非輻射衰減(即熱產生)實現的、二聚體Cy7的光熱療法(PTT)效率顯著高于單體Cy7和ICG。
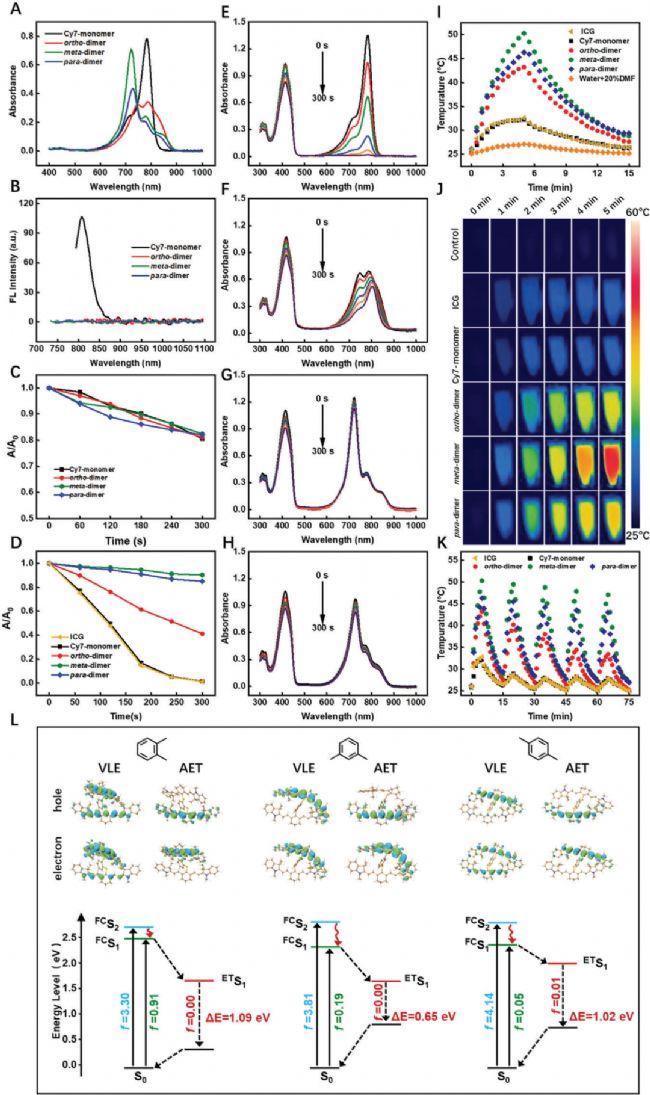
二聚體Cy7染料中強大的PET傾向有助于它們的光穩定性,并維持它們隨時間的光熱效率。由于熒光猝滅導致的激發態壽命減少,使這些染料不易光漂白。
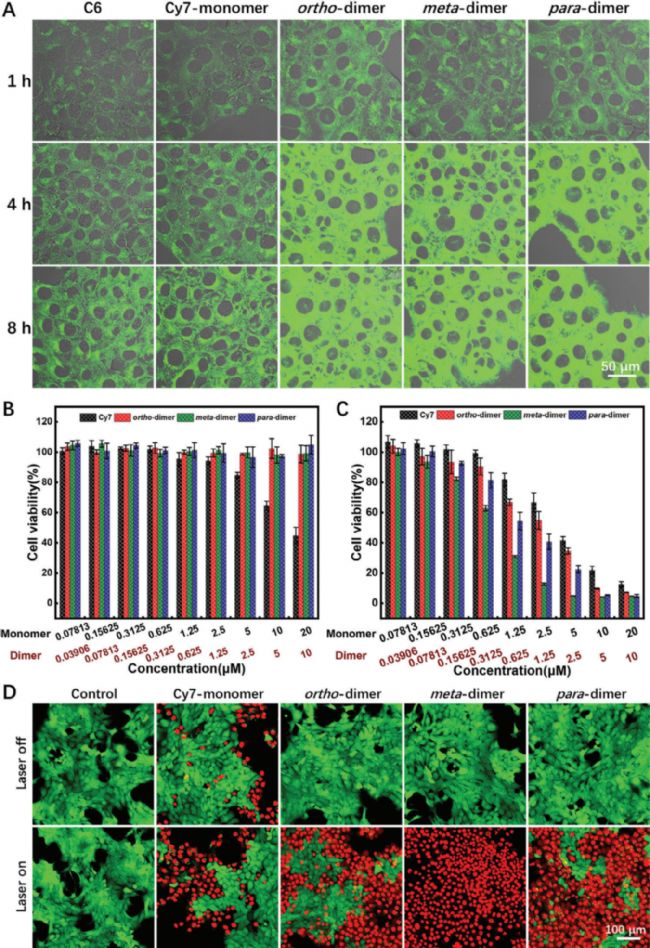
體外光療實驗結果表明,二聚體具有良好的生物相容性,并且不同程度上表現出比單體具有更強的光毒性,其中,幾乎所有用間二聚體處理的4T1細胞都在照射后死亡,這突顯了這些特定二聚體的強大光療能力。
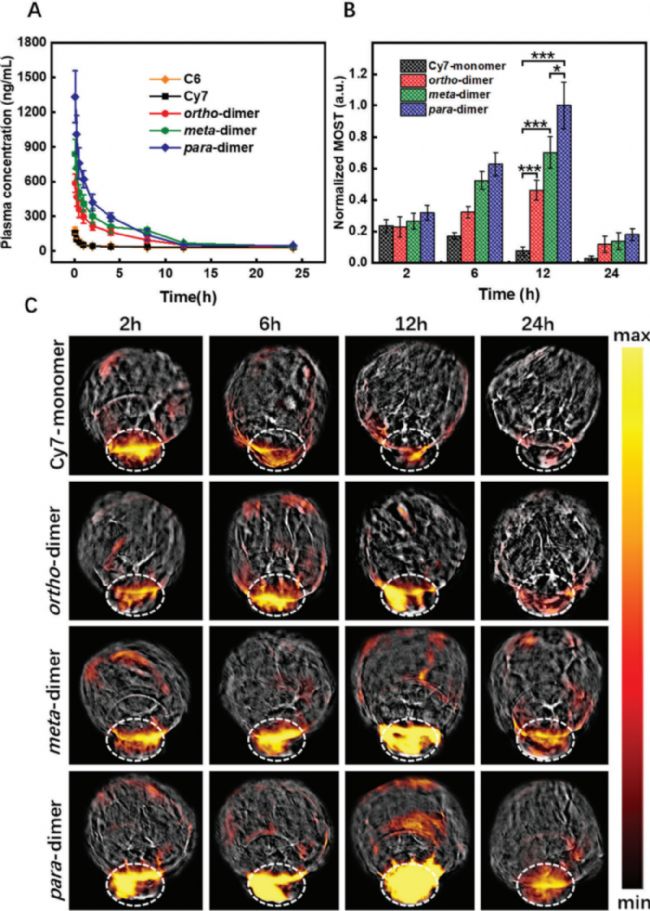
體內藥代動力學結果顯示,二聚體Cy7在體內的循環增強。利用二聚體Cy7的顯著光熱效應,采用光聲成像檢測其體內腫瘤積聚,注射后第12小時觀察到二聚體Cy7的峰值光聲信號,對二聚體在腫瘤組織中表現出最強光聲強度。
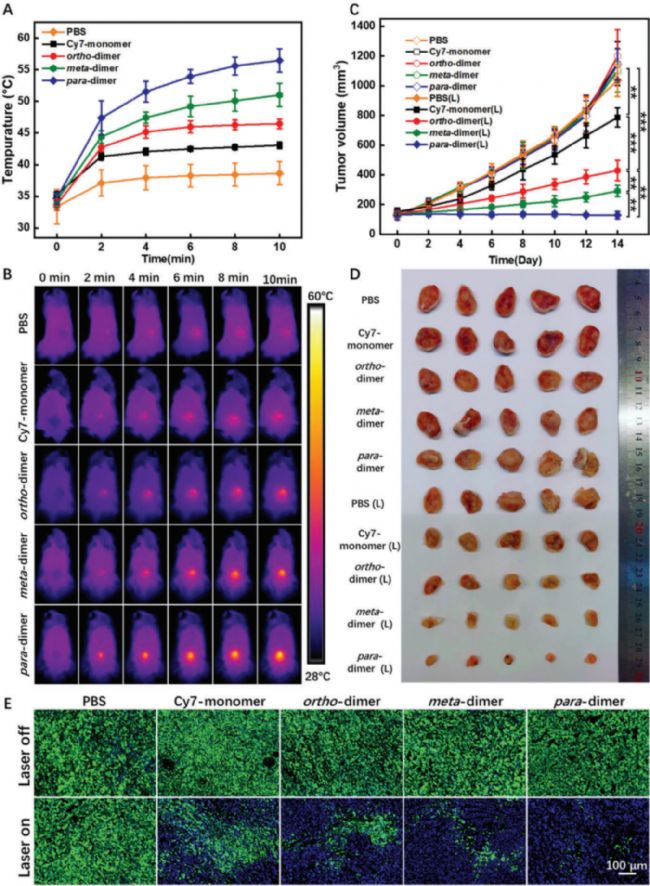
體內抗腫瘤實驗顯示,對二聚體顯示出最顯著的抗腫瘤活性,腫瘤體積幾乎沒有增加。
該研究成功開發了一種新型二聚體Cy7光熱劑,通過分子內和分子間聚集的協同作用,實現了高效的體內自我傳遞和光熱療效,其中對位二聚體展現出了最佳的穩定性和抗癌效果,為光熱療法提供了一種有希望的新一代治療策略。
原文鏈接:
https://doi.org/10.1002/adfm.202316452
關于iThera Medical小動物多光譜光聲斷層掃描(MSOT)系統
MSOT多光譜光聲斷層掃描系統是由德國iThera Medical公司研發并推入市場的光聲成像設備,主要應用包含:可實現動物活體內實時動態成像,檢測體內多種光譜信號,獲得特異性標記的報告分子或生物標記物在生物體內分布的斷層影像,為研究生物組織的結構形態、生理特征、代謝功能、病理特征等提供了重要手段,同時滿足現今小動物活體成像趨勢所需的“功能”和“結構”成像,主要應用在腫瘤研究、腫瘤藥物靶向與代謝檢測、血氧分布與濃度研究、分子探針開發、腦科學研究、藥物遞送、藥物動力學與生物分布研究等領域。
關于冷泉港生物
冷泉港生物科技股份有限公司于1987年在中國臺灣成立,深耕中國市場的精密儀器及試劑銷售30多年,一直致力于將全球生物醫學前沿技術引入中國市場并獲得獨家代理權,如NanoString、MaxCyte、Cell Microsystems、CELLINK、iThera Medical和Phoenix Micron、CYTENA等,助力國內科學研究及轉化醫學研究。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





