inscopix在觀察全麻藥物激活大腦杏仁核中的中央鎮痛環路的應用
全麻藥物可激活大腦杏仁核中的中央鎮痛環路
----Inscopix nVista神經元成像系統應用
----Inscopix nVista神經元成像系統應用
對于全身麻醉來說,麻醉藥物一般會引起意識的喪失,同時我們也失去了痛覺感知,于是手術得以進行。
但全身麻醉一般也會有獨立于意識喪失的鎮痛作用,具體實例就是正在手術的病人知曉手術室內正在發生的事情,醫生的交談,但這種麻醉作用的潛在神經機制還不清楚。以前,人們認為低劑量麻醉藥物可通過阻斷脊髓背角周圍的神經傳遞來誘導鎮痛作用。但這種方式下,患者在沒有疼痛的同時仍能感覺到刺激,與這一想法不符。說明低劑量的麻醉鎮痛可能在高于脊髓的水平上起作用,從而在分離出痛覺的同時,也可以感知有害的刺激。
最近在《nature neuroscience》上發表的一篇文章對此進行了研究,研究使用了時下最熱的新技術,自由動物在體神經元鈣成像技術,為揭示鎮痛之下的神經機制提供了強有力的證據。
下面我們來一起了解這篇研究。
結果
實驗使用早期基因Fos作為最近激活的神經元的標志物,通過施行一個較長的實驗方案,觀察受刺激激活的神經元位置,即CeAGA中受麻醉劑激活的Fos+細胞。
實驗中觀察到在麻醉劑作用下,CeAGA中來自多個亞區域的神經元被激活,即神經元的多個亞群對麻醉有響應。
使用設計的CANE方法可以準確定位出受相應麻醉藥物激活的神經元。通過長時間嚴格計劃的病毒注射,可以發現在小鼠大腦左右兩側的CeAGA均有相似大小的神經元群體,受麻醉刺激而響應。除此之外,在使用不同麻醉藥物進行的實驗發現,不同藥物引起的響應神經元有部分重疊。由于異氟烷可靠地誘導了最大數量的CeAGA神經元群體中的Fos+響應,因此,在所有后續實驗中,研究人員將CANE與異烷麻醉結合使用以選定實驗分析的CeAGA神經元。
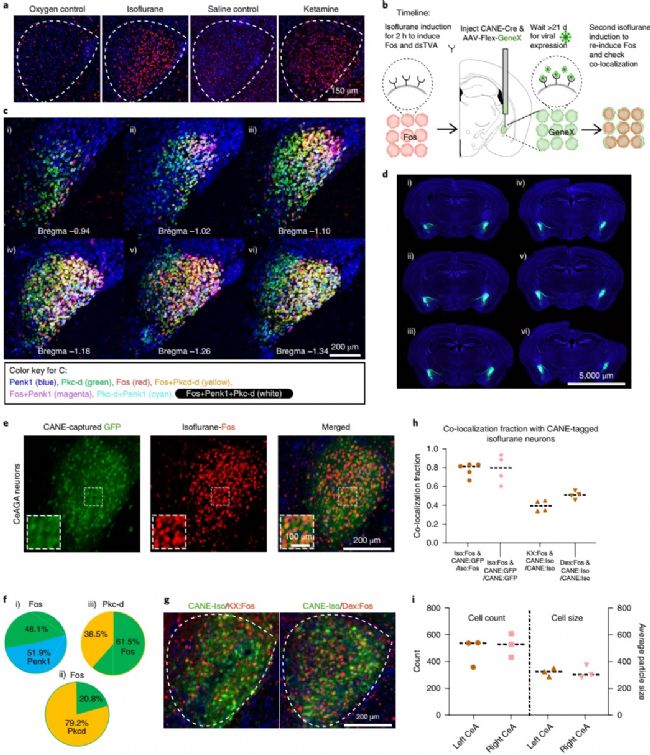
圖1,CeAGA中受麻醉藥物激活引起的神經元群體
為了了解自由移動小鼠在麻醉劑誘導及其維持過程中CeAGA神經元的活動,研究人員進行了小鼠在體的鈣成像實驗。通過設計好的實驗策略在小鼠CeAGA神經元中表達鈣指示劑GCaMP6m。隨后,使用高度集成的微型熒光顯微鏡并結合梯度折射率透鏡將小鼠大腦內部的神經元鈣活動在顯示器上進行直觀的觀察,將小鼠用異氟烷處理,并使用MIN1PIPE方法處理視頻數據,就這樣記錄到了這些活動細胞的鈣動力學變化。再次異氟醚的再次暴露激活了許多CANE-GCaMP6m捕獲的CeAGA神經元。為了描述活動模式,他們根據單個神經元平均熒光的比率對神經元進行了排序。分析表明,在異氟烷處理期間,有89.7%的成像神經元顯示熒光增強。
通過對神經元活動數據的分析,發現在之前實驗中使用基于Fos的CANE方法選定的CeAGA都會被異氟烷重新激活,并且也會大量被其他麻醉劑激活,這些體內成像結果有力地支持了可被異氟烷和氯胺酮麻醉作用激活的CeAGA神經元并集的存在。
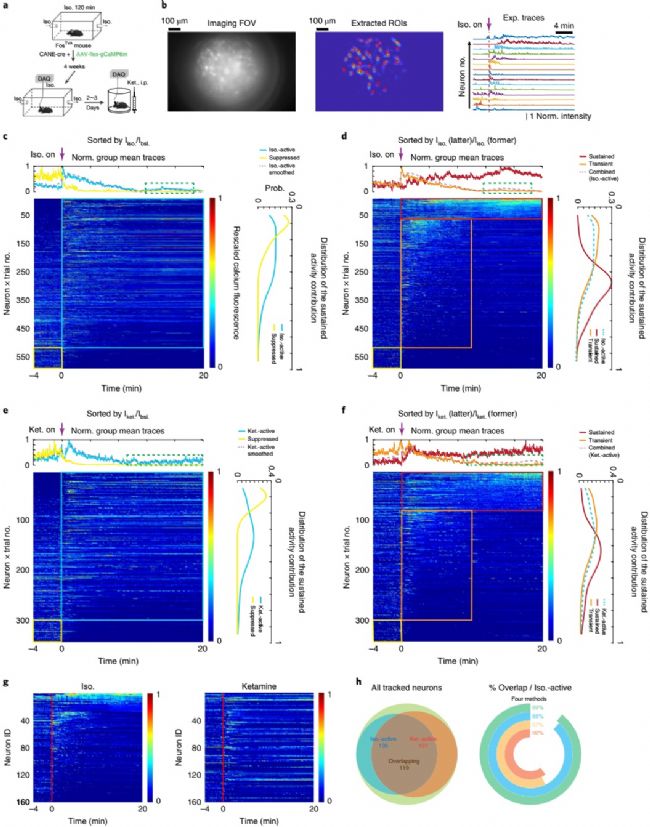
圖2,在受異氟烷和氯胺酮麻醉期間,鈣成像方法記錄下的CeAGA神經元活動模式
通過光遺傳方法對小鼠大腦內的特定神經元進行激活或抑制,可以研究特定神經元的具體功能。在該研究中,實驗人員通過在小鼠大腦特定神經元上表達興奮性或抑制性受體,并結合行為學實驗,觀察小鼠在給藥前后對痛覺刺激的反射行為有什么變化。實驗設計了3種痛覺刺激,分別是冷,熱,針刺激,分別作用在野生型小鼠和急性痛覺模型小鼠身上,結果發現,在激活CeAGA神經元后,小鼠對痛覺的敏感度下降,光抑制之后,敏感度上升。小鼠對傷害性刺激的條件反射行為受到了影響。
除了直接的撤離或防御行為外,急性疼痛還會引起動物自身的照顧行為,就比如人手被燙傷后會立刻往受傷部位吹氣一樣。在對小鼠的這一行為進行觀察后發現,光遺傳刺激CeAGA的神經元也會顯著影響這種自我保護性照顧行為。
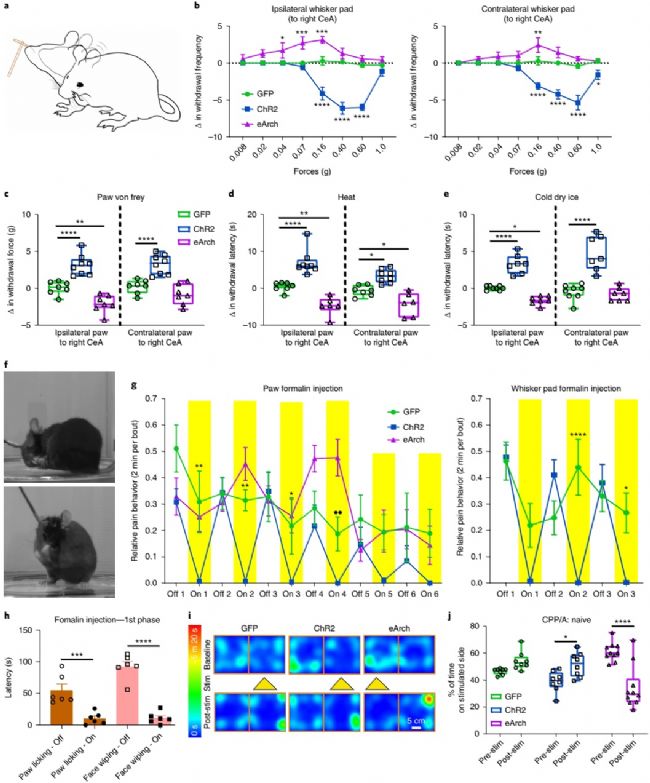
圖3,在野生型小鼠和急性痛覺模型鼠上對CeAGA神經元進行的激活或抑制雙向的調節了痛覺相關行為
CeAGA神經元的光遺傳抑制使CeAGA-eArch小鼠對機械,熱和冷刺激高度敏感,并加劇了疼痛引起的關懷行為,這使得研究人員思考CeAGA神經元的基礎活動水平以超敏行為起到預防刺激的可能性。換句話說,短期的有害刺激是否會改變正常小鼠的CeAGA神經元自發水平的活動。通過實驗驗證,發現CeAGA神經元的活性并沒有對施加的刺激有明顯受影響的跡象,細胞群體行為表現平穩。在對單個神經元進行分析后發現,大多數在受到刺激后并不會改變其基礎活動水平,與群體表現一致,表明CeAGA神經元可能在很大程度上呈現的是動物內部狀態,而不是短期的有害刺激。
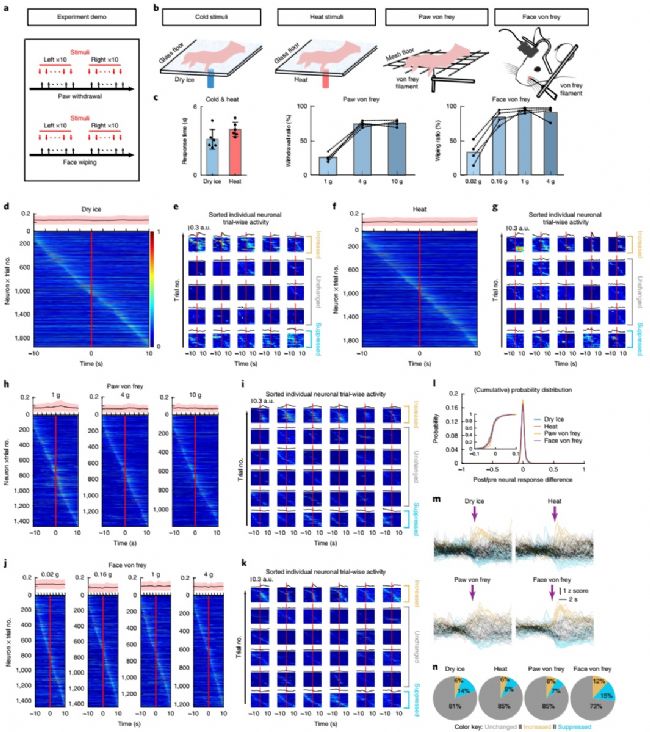
圖4,感覺測試期間對CeAGA神經元活動的在體鈣成像
下一個關鍵問題是激活CeAGA神經元是否可以抑制慢性神經性疼痛下的機械性超敏反應。他們用CeAGA-GFP和CeAGA-ChR2小鼠制作了慢性口面神經性疼痛模型,其中將眶下神經結扎在面部右側,即為慢性阻塞損傷(CCI)。這種傷害導致IoN連接側的胡須墊處對非有害觸覺刺激持續敏感。在沒有光刺激的面部von Frey試驗中,CCI-IoN小鼠開始表現出對兩側正常無害的0.02 g力有退縮反應。這與已知的由神經性疼痛引起的機械性超敏反應或異常疼痛相一致,包括未受傷一側的鏡像疼痛。值得注意的是,單側ChR2激活CeAGA神經元會極大地減少受傷側的撤離反應,甚至對1.0 g刺激都沒有反應,而對照組實驗并沒有改變其敏感性。同時注意,在未受傷害的狀態和未受傷害的一側,即使通過ChR2激活CeAGA神經元,1.0 g von Frey刺激施加于面部也會引起退縮反射。相比之下,在CCI-IoN小鼠身上,CeAGA的激活表明受傷一側在響應1.0 g時受損,說明神經性疼痛下的機械性超敏反應主要是由異常的中央加工引起的。
研究人員還在CCI-IoN動物中進行了條件位置偏好實驗(CPP)。 光激活CeAGA-ChR2小鼠的CeAGA神經元產生對光激活腔室的位置偏好記憶,而對照組CeAGA-GFP小鼠不會,大概是由于該位置疼痛緩解。此外,CCI-IoN動物表現出自發性不對稱地擦拭受傷側,說明它們感受到自發性疼痛。 CeAGA-ChR2小鼠中CeAGA神經元的ChR2激活顯著減少了CCI-IoN小鼠的總擦拭時間,并且在刺激后期也具有持久作用。綜上所述,CeAGA神經元的激活可有效抑制慢性神經性疼痛模型中與疼痛有關的行為。
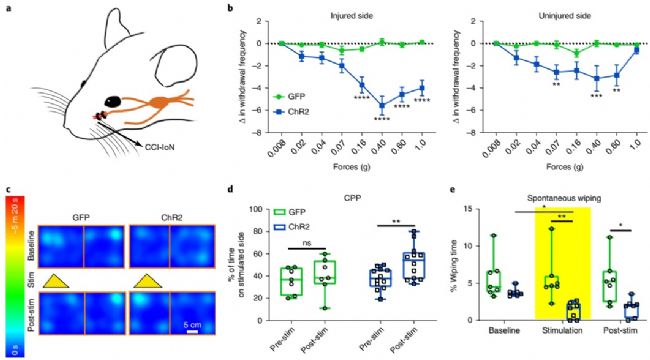
圖5,在慢性阻塞物損傷模型鼠中的CeAGA神經元激活強烈降低了傷害感受相關行為,并驅動了條件位置偏好。
研究人員對CeAGA投射出來的神經元進行了觀察,發現它投射到大腦中非常廣泛的區域。分析投射目標區域,研究人員注意到,許多CeAGA神經元的軸突靶標含有福爾馬林疼痛誘導的Fos +神經元。考慮到CeAGA神經元是GABA能的,原則上它們處于通過其投射有效抑制這些疼痛激活神經元活動的理想位置。實驗發現接受雙向光遺傳激活CeAGA區域的CeAGA-ChR2小鼠在所有投射目標區域均顯示出Fos+神經元數量的明顯減少。因此,CeAGA神經元可以有效抑制大腦中許多疼痛處理中心的神經激活。
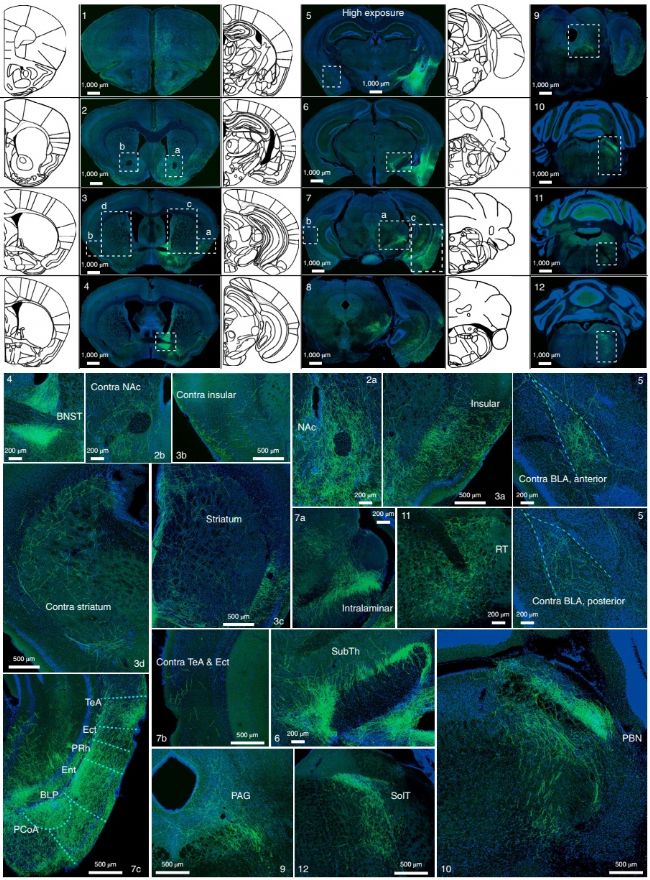
圖6,從CeAGA神經元到全腦的投射
研究開始研究人員假設全麻的鎮痛作用與麻醉引起的意識喪失是分開的,尤其在低麻醉藥物濃度下。而在對由1.5%異氟烷捕獲的CANEISO-GCaMP6m神經元進行在體成像時,也確實發現在0.5%異氟烷下,更多的神經元被持續激活。為了準確考察劑量效應,研究人員轉而使用小劑量的氯胺酮,這在臨床上具有鎮痛作用。之前的研究表明,氯胺酮在12 mg/kg時對小鼠有鎮痛效果。在三個成像實驗(1.5%異氟烷,常規劑量的氯胺酮和低劑量的氯胺酮)中得到的結果表明,大多數被跟蹤觀察的神經元在所有三種情況下均被激活,包括低劑量氯胺酮。
為了測試低劑量氯胺酮的鎮痛作用是否需要CeAGA神經元的活性,研究人員對光遺傳抑制小鼠進行了辣椒素試驗。在辣椒素注入鼠爪后,鹽水組引起了強有力的爪舔。小劑量氯胺酮則可顯著減少舔舐時間。值得注意的是,當CeAGA神經元在辣椒素+氯胺酮條件下被光遺傳抑制時,小鼠舔爪的時間與辣椒素+氯胺酮條件下的時間相似,此時氯胺酮的鎮痛作用被阻礙了。該結果表明,CeAGA神經元的活性是小劑量氯胺酮緩解疼痛的作用所必需的。
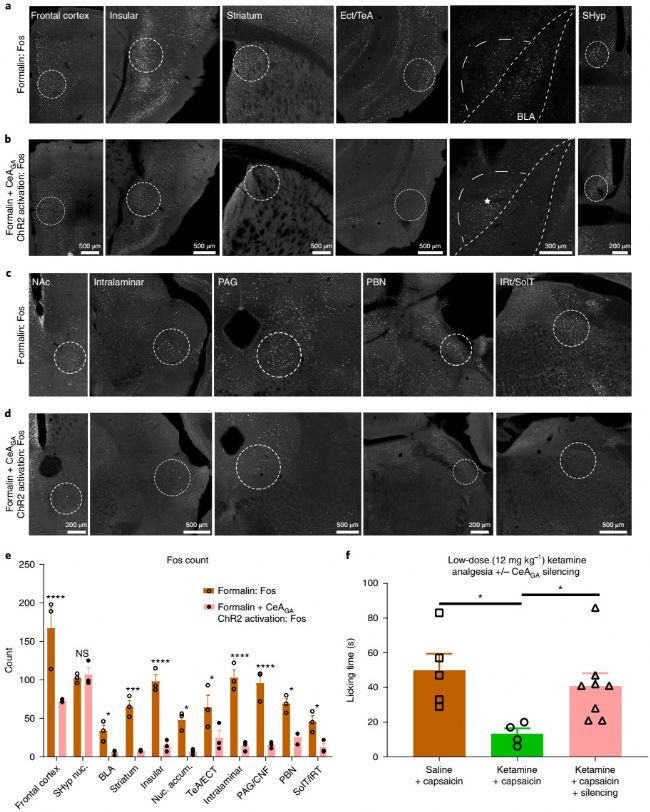
圖7,對于所有CeAGA的目標區域,CeAGA神經元的激活降低了福爾馬林所誘導產生的活性,而抑制的CeAGA神經元則阻礙了低劑量氯胺酮的鎮痛作用。
CeA以前曾被認為是應激和安慰劑誘導的鎮痛的關鍵結構,CeA的損傷會損害其鎮痛作用。
目前還不知道全身麻醉藥如何誘導CeAGA神經元的瞬時或持續活化,也不知道持續激活CeAGA神經元是否會上癮。但這項工作提出了利用這種內源性止痛系統緩解慢性疼痛的令人興奮的可能性。可以給發展下一代不含鎮靜作用的止痛藥留一些啟示。
(由格羅貝爾生物科技公司供稿,未經同意不得轉載)
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





