Peri Cruiser創(chuàng)新技術平臺的原理及在CAR-T治療實體瘤中的應用優(yōu)勢
來源:醫(yī)藥魔方Pro
CAR-T細胞療法在血液腫瘤治療中取得了顯著成效,但在實體瘤中仍面臨諸多挑戰(zhàn)。其中,最突出的問題是中靶脫瘤毒性(on-target off-tumor toxicity)。由于實體瘤的靶點多數(shù)為腫瘤相關抗原(TAA),而這些靶點在正常組織中也有表達,因此CAR-T細胞可能會誤傷正常組織,從而引發(fā)嚴重的毒副作用。
 來源:Science Translational Medicine
來源:Science Translational Medicine1月22日,最新發(fā)表在Science Translational Medicine雜志上的一篇封面論文中,易慕峰聯(lián)合上海交通大學附屬仁濟醫(yī)院翟博教授(現(xiàn)同濟大學附屬東方醫(yī)院微創(chuàng)介入治療中心主任)等團隊開發(fā)了Peri Cruiser®創(chuàng)新技術平臺,通過調整CAR-T細胞在體內的組織分布,顯著減少了因腫瘤相關抗原(TAA)在正常組織中的表達而導致的中靶脫瘤毒性。這一平臺不僅保留了CAR-T對原位腫瘤的殺傷能力,還能很好地控制腫瘤轉移,為CAR-T在實體瘤治療中的應用提供了突破性的解決方案。
CAR-T死亡之吻 | 該封面圖展示了經(jīng)過工程改造后降低了脫瘤(off-tumor)毒性的CAR-T細胞(綠色),形成功能性免疫突觸,準備殺死結腸癌細胞(洋紅色)。細胞核用藍色表示。盡管CAR-T細胞在癌癥治療中取得了成功,但由于缺乏獨特的腫瘤抗原,往往會導致中靶脫瘤(on-target, off-tumor)毒性。為了克服這一臨床挑戰(zhàn),Wang等人通過基因修飾CAR-T細胞來改善腫瘤特異性靶向,防止其與內皮細胞相互作用,降低CAR-T細胞遷移到健康組織的能力,同時保留了其進入和根除腫瘤的能力。這項研究提出了改進CAR-T細胞療法的新方法——最小化其毒性,同時增強其抗腫瘤潛能。(來源:Science Translational Medicine)
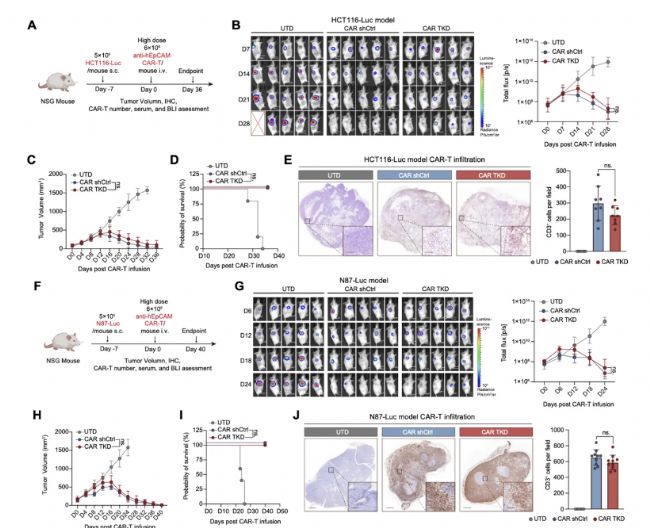
Peri Cruiser®技術平臺基于多重shRNA技術在一個慢病毒載體上同時實現(xiàn)CAR的表達和敲低多個T細胞關鍵粘附和遷移分子(CD11a, CD49d, and PSGL1)的表達,可以顯著降低CAR-T細胞在正常組織中的毒性。研究結果顯示,該技術能夠顯著降低CAR-T進入正常組織(例如肝臟和肺),而保留了進入腫瘤的能力。
通過連續(xù)殺傷等多種體外實驗證明,降低黏附分子的表達能夠增強CAR-T細胞對腫瘤的持續(xù)殺傷能力,并降低耗竭marker的表達,提高了記憶細胞的比例,同時對CAR-T與腫瘤細胞免疫突觸的形成沒有影響,顯示出該技術平臺的多種優(yōu)勢。
 來源:Science Translational Medicine
來源:Science Translational Medicine研究人員還在結腸癌和胃癌模型中進行了體內藥效的研究,Peri Cruiser®技術平臺能夠保留對多種實體腫瘤和轉移腫瘤的抑制能力,該平臺總體展現(xiàn)出了良好的抗腫瘤活性。
總結來說,這項研究不僅展示了一種全新的CAR-T技術思路,還為實體瘤CAR-T療法更安全有效地應用提供了解決方案。
- PCL-PVAc-PEG在活性物遞送和生物材料上的應用優(yōu)勢
- PROTAC連接子中作用機制及氮雜環(huán)的結構優(yōu)勢與功能特性
- OK432在腫瘤和免疫研究中的作用機制及應用優(yōu)勢
- 鐵調素Hepcidin-25作為鐵代謝和免疫反應關鍵調節(jié)因子的功能和作用
- 糖蛋白Fibronectin在細胞培養(yǎng)中的功能及作用
- TDP-43的結構與功能及在漸凍癥(ALS)等神經(jīng)退行性疾病中的作用機制
- DNP-BSA(2,4-二硝基苯偶聯(lián)牛血清白蛋白)在免疫學研究與檢測中的作用
- AbMole LPS(脂多糖)在免疫激活、動物造模等方面的應用及案例分享





