合成膜內蛋白水解受體(SNIPR)作為CAR-T技術在腫瘤治療上的優勢
文章來源:談思生物
在對抗腫瘤的過程中,如果治療手段在消滅腫瘤細胞的同時對正常細胞造成嚴重損害,顯然不是理想的策略。無論是傳統的化療還是新興的免疫療法,它們在攻擊腫瘤細胞時都可能波及到體內的健康細胞,導致“誤傷”和不良反應。
如何精確區分腫瘤細胞與健康細胞,對于CAR-T細胞療法的研究者而言,是一個至關重要的挑戰。CAR-T細胞是經過基因工程改造的免疫細胞,其表面的嵌合抗原受體(CAR)能夠識別腫瘤細胞特有的抗原,從而實現對腫瘤細胞的精準攻擊。然而,非腫瘤組織有時也會表達相同的抗原,這可能導致患者出現非腫瘤組織的靶向毒性。
最近,《自然》雜志上發表了加州大學舊金山分校(UCSF)的Kole Roibal博士與2024年諾貝爾化學獎得主David Baker教授合作的一項研究成果,他們開發了一種可定制的受體——合成膜內蛋白水解受體(簡稱SNIPR),這種受體能夠確保CAR-T細胞僅在特定環境下,如腫瘤微環境中被激活,從而精確識別并攻擊癌細胞,減少對非腫瘤組織的毒性。
研究者認為,這項技術有望帶來更精確、更安全的抗癌治療方法,并且這種方法還有潛力被用來開發針對其他類型疾病的新型靶向治療策略。

早在2016年,論文的共同通訊作者Kole Roibal博士及其團隊就開發出了一種名為synNotch受體的傳感器。這種受體能夠被嵌入細胞中,進而控制細胞的行為和功能,例如引導T細胞執行特定任務:識別同時表達腫瘤抗原A和B的細胞,并僅在這種情況下激活T細胞的殺傷機制。本質上,synNotch受體是基于天然Notch受體的一種工程化改造版本,它的一部分位于細胞外,用于識別特定的目標,如腫瘤特異性抗原;而另一部分位于細胞內,一旦受體被激活,其胞內部分就會進入細胞核,進而激活或抑制特定基因的表達——比如控制CAR表達的基因。這種方法在很大程度上減少了非特異性的靶向效應。
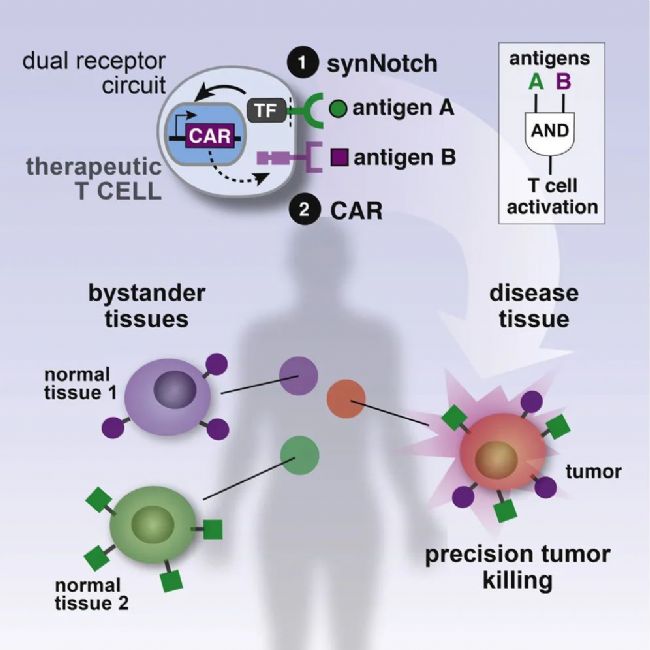 ▲synNotch示意圖
▲synNotch示意圖這項新研究中的SNIPR是synNotch受體的“進階版”,它經過了進一步的工程改造。SNIPR的胞外部分不僅能夠被細胞表面的標記激活,還新增了被可溶性配體激活的能力,這意味著它能夠檢測細胞周圍環境中的任何感興趣的自由漂浮分子,例如腫瘤環境中的免疫信號分子。當SNIPR與特定的分子結合后,多個受體會聚集并觸發內吞作用,翻轉至細胞內部,并在pH依賴性條件下發生切割。一個細胞內插入的多個SNIPR可以影響多個不同的基因,或者以不同的方式影響同一個基因,從而調節基因的活性。
基于這一原理,定制化的SNIPR能夠確保細胞在特定環境中執行特定的任務,比如釋放藥物、激活免疫反應或向其他細胞傳遞信號分子等。
在《自然》雜志發表的這篇論文中,研究團隊將新設計的SNIPR受體整合到了CAR-T細胞中,并設定了SNIPR受體由可溶性免疫分子TGF-β和VEGF激活的條件。這兩種免疫分子在腫瘤周圍的濃度通常較高。因此,裝備了SNIPR的CAR-T細胞只有在檢測到TGF-β和VEGF時才會激活其抗腫瘤的活性,這意味著它們不會在沒有癌細胞的身體區域引發免疫反應。
研究者在含有人類腫瘤的小鼠模型中進行了初步的驗證工作,結果觀察到裝備了SNIPR的CAR-T細胞能夠精確地攻擊腫瘤,在腫瘤體積減少的同時,并未引起體重下降、器官損傷等常見的CAR-T治療相關不良反應。
研究團隊接下來計劃進行CAR-T細胞的臨床試驗,并探索SNIPR在不同細胞類型中的應用,以促進不同細胞類型之間的通信和與環境的互動,這可能會帶來更廣泛的治療應用。
免責聲明:本文內容來源于官方網站,旨在為大家提供知識共享,不構成任何專業建議。本資料中所涉及的圖片及文字內容僅供參考,若侵犯肖像權或者著作者權等知識產權,請聯系我方刪除。





