蛋白表達載體的構建、表達效率提高方法及不同表達宿主的優缺點
文章作者:red red sea 文章來源:Super Lab
背景介紹:在蛋白表達系統的相關研究中,從頭合成蛋白質并不是一個可行的選擇。因此需要借助活細胞或細胞器用作生產和構建蛋白質的工廠。利用基因重組技術將特定基因的DNA序列作為模板生成蛋白質,被稱為重組蛋白。其原理是將目的基因通過電轉化或者熱激等手段轉入合適的宿主中,利用宿主的特定生理、生化和遺傳特點進行目標蛋白大量表達及純化的生物技術。廣泛應用于結構研究、生物治療、藥物開發等。本篇推文將從蛋白表達載體的構建到如何提高蛋白的表達效率以及表達宿主如何選擇來進行介紹,希望給做蛋白表達的初學者提供一些幫助!
蛋白質的產生
蛋白質合成的步驟,遺傳信息儲存于 DNA中,以此為模板經轉錄生成信使 RNA,mRNA編碼的信息隨后被翻譯成氨基酸序列形成蛋白質(圖1)。真核與原核生物轉錄和翻譯有一定區別。原核生物中轉錄和翻譯是同時發生的。轉錄產生的信使RNA不需要剪切、拼接等,真核生物轉錄在細胞核中進行,翻譯在細胞質中進行,該過程是存在空間分隔的且有順序發生,翻譯后通過多種方式對多肽進行修飾,形成蛋白質結構。
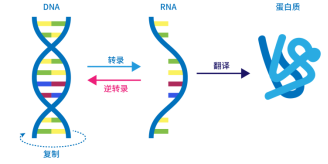
圖1. 中心法則
蛋白表達載體的構建
通常來說,典型的蛋白質表達載體需包括以下主要元件:
• 多克隆位點 (MCS) ;• 目的基因表達框:包括啟動子和基因終止或 poly (A) 信號 ;• 細菌的復制起始點 (ori) ;• 宿主的抗生素篩選標記:如嘌呤霉素(puromycin)、新霉素(neomycin)和殺稻瘟菌素(blasticidin) ;• 大腸桿菌的抗生素篩選標記:如氨芐青霉素(Ampr)、氯霉素(Camr)、卡那霉素(Kanr等;• 表位標簽等 。
表1. 重組蛋白表達系統中常用的組成型和誘導型啟動子
| 宿主 | 組成型啟動子 | 誘導型啟動子 |
|---|---|---|
| 哺乳動物 | CMV ;EF-1α;UbC;SV40 | 含Tet On的啟動子;GAL4-USA |
| 大腸桿菌 | T7 | Lac |
| 昆蟲 | Ac5;p10; | MT |
| 酵母 | GAP | GAL1;AOX1 |
蛋白標簽是重組蛋白制備過程中與目的蛋白融合表達的蛋白或多肽,標簽蛋白的作用一般有:促進目的蛋白的可溶性和穩定性;便于目的蛋白被檢測;便于目的蛋白純化。隨著研究的需求和技術的發展,各種標簽應運而生,多樣化的標簽可以滿足不同的實驗目的。
表2. 常見的蛋白檢測標簽
| 標簽 | 應用說明 |
|---|---|
| His | 對目的蛋白的空間結構影響極小,一般無需切除也不會對目標蛋白功能產生太大影響。 |
| HA | 源于流感病毒的紅細胞凝集素表面抗原決定簇,對目標蛋白的影響較小。 |
| c-Myc | 來源于人類原癌基因Myc,由于可獲得高特異性Myc單克隆抗體,因此在Western blot,免疫熒光和免疫沉淀中被廣泛使用。但很少用于蛋白純化。 |
| Flag | 包含腸激酶的識別位點,方便去除,適合融合在目標蛋白N端。親水性高,通常不會使與其連接的蛋白質失活,常用于真核表達系統中目標蛋白的檢測。 |
| 3×Flag | 可免疫原性和與抗體的親和性得到極大增強,適用于真核生物低水平表達的蛋白的檢測和純化。 |
| S | 通常將 S-tag 構建到目標蛋白的 N 末端或 C 末端上,可以使用商業化的 S-tag 抗體進行免疫檢測。 |
| T7 | T7標簽,一種源自T7噬菌體衣殼蛋白的表位標簽,可購買商業化的Anti-T7抗體檢測。T7標簽常用于蛋白質印跡實驗。 |
| V5 | V5可融合到目標蛋白C端,常用于哺乳動物和昆蟲細胞表達系統蛋白質印跡,免疫熒光和免疫沉淀檢測。 |
表3. 蛋白純化標簽及應用
| 標簽 | 應用和純化方式 |
|---|---|
| His | 組氨酸殘基側鏈與固態的鎳有強烈的吸引力,可用于固定化金屬螯合層析(IMAC),對重組蛋白進行分離純化。 |
| GST | 該表達系統表達的GST標簽蛋白可直接從細菌裂解液中利用含有還原型谷胱甘肽瓊脂糖凝膠親和樹脂進行純化。 |
| MBP | MBP(麥芽糖結合蛋白),是大標簽,分子量大小在40kDa以上,由大腸桿菌K12的malE基因編碼。MBP可增加目標蛋白在細菌中的溶解性,尤其是真核蛋白,也可以增加融合蛋白表達量。融合蛋白可通過交聯淀粉親和層析一步純化。 |
| SUMO | 一種小分子泛素樣修飾蛋白,可作為融合標簽,不但可以提高融合蛋白的表達量,且具有抗蛋白酶水解以及促進目標蛋白正確折疊,提高重組蛋白可溶性等功能。該標簽主要用于改善目標蛋白的表達,并非常用的純化標簽,要用于純化可采用雙標簽。 |
| CBD | CBD和一個來源于酵母的intein蛋白質組成一個雙效的融合標簽。融合表達產物在掛上親和層析柱后只需要在低溫(4℃)條件下用含DTT或者巰基乙醇,或者半胱氨酸的溶液洗脫,即可將目的蛋白洗脫,而將融合標簽留在純化柱上,而還原劑的小分子可以非常簡單的去除。 |
| Strep-tag II | Strep標簽融合蛋白與鏈霉菌抗生物素蛋白柱上的基質特異性結合,D-生物素或其衍生物可作為洗脫劑,從而實現融合蛋白的特異性純化。 |
提高蛋白表達的策略
密碼子優化:選擇最合適的表達載體,構建時進行密碼子優化,使蛋白質在宿主內表達更完全;提高蛋白溶解度:①調節表達條件參數:優化培養基的濃度、pH值、類型甚至是批次或批號,還可向培養基中添加特定的試劑,例如生長因子和細胞周期調節劑來提升蛋白表達水平;②融合蛋白標簽:低產量提高蛋白表達的策略可使用分子融合伴侶技術。該策略利用啟動子、增強子、標簽和其它融合元件來提高蛋白的溶解度。蛋白標簽是插入到重組蛋白上的短肽序列,通常會在蛋白表達結束時采用酶切或化學試劑去除,比如His,Flag,GST;Fc等。③溫度:對于HEK293和其它哺乳動物細胞系,在37°C、5% CO2孵箱中培養細胞。有研究表明,在轉染后24小時將溫度從37°C降至33°C培養,可提高HEK293細胞的蛋白表達。
如何選擇蛋白表達系統
目前,較為主流的表達宿主有大腸桿菌(E.coli)、畢赤酵母(P.pastoris)、昆蟲-桿狀病毒(Bac-to-Bac系統)以及哺乳動物細胞系(CHO、HEK293)等。
| 蛋白表達系統 | 優點 | 缺點 |
|---|---|---|
| 細菌 | 1. 遺傳背景清楚;2. 繁殖快、成本低、抗污染能力強;3. 表達量高、表達產物分離純化相對簡單、穩定性好;4. 商品化的載體和菌株種類非常齊全、適用范圍廣等。 | 1. 沒有真核轉錄后加工的功能,沒有翻譯后修飾;2. 表達的蛋白質經常是不溶的,容易形成包涵體;3. 有一些真核蛋白的產量和活性較低;4. 難以表達大分子哺乳動物蛋白質;5. 可能會產生一些致熱源(內毒素) |
| 酵母 | 1. 結合了真核和原核的優點,可生產翻譯后修飾的分泌蛋白和胞內蛋白;2. 經濟高效,部分真核翻譯后修飾,如糖基化,磷酸基化。 | 1. 可能形成不正確的蛋白糖基化;2. 培養上清多糖濃度高不利于純化 |
| 昆蟲 | 1. 表達水平高(特別是細胞內蛋白),較快的生長速度,有效的細胞折疊,中度可擴展性;2. 廣泛的翻譯后修飾,糖基化與哺乳動物細胞類似,相對容易地酶促的去糖基化(對于蛋白結構測定有利),3. 無內毒素。4. 易于操作。桿狀病毒基因組較小,分子生物學特性簡單;5. 昆蟲細胞懸浮生長,容易放大培養;6. 可表達較大的外源性基因而不影響本身增殖; | 培養基昂貴(現已培養基成本有所下降,各種無血清培養基廣泛被應用),需要大量的病毒,親肽的分泌通路低效,糖基化仍然不同于哺乳動物細胞,病毒侵染會導致細胞裂解和潛在的表達蛋白降解。 |
| 哺乳動物穩定表達系統 | 1. 蛋白活性:翻譯后再加工修飾折疊的功能產生的外源蛋白質,更接近于蛋白質的天然狀態。2.正確的高級結構(如糖基化)。3.在蛋白的起始信號、加工、分泌、糖基化方面具有獨特優勢,適合表達完整的大分子蛋白。 | 培養基成本高,培養周期長,至少一個月以上,培養較困難,表達量較低。構成復雜、操作技術要求高、表達產量不大、產率低 |
| 哺乳動物瞬時表達系統 | 1. 適度快速表達2. 很好表達膜蛋白和分泌蛋白3. 所有蛋白都能進行折疊和最真實的翻譯后修飾 | 1. 比較貴2. 胞內蛋白產量低 |
總之,各種表達系統各有優缺點,使用大腸桿菌表達系統成本相對較低,并且能夠在較短時間內獲得表達產物,但目的蛋白常以包涵體形式表達,產物純化困難,且原核表達系統翻譯后加工修飾體系不完善,表達產物的生物活性較低。酵母和昆蟲細胞表達系統蛋白表達水平高,成本低,但翻譯后加工修飾體系與哺乳動物不完全相同。哺乳動物表達系統產生的蛋白質更接近于天然狀態,但表達量低,操作繁瑣。因此,選擇表達系統時,應充分考慮各種因素,如要表達蛋白的性質、生產成本、表達水平、安全性、表達周期等。





