AniView多模式動物活體成像助力開發近紅外和磁響應鼻腔藥物遞送系統

近日,南昌大學轉化醫學研究院王小磊團隊,開發了一種近紅外和磁響應鼻腔藥物遞送系統。相關研究成果已經發表在國際權威期刊《Advanced Materials》(IF=29.4、一區top期刊)上。
抑郁癥和認知缺陷已經成為許多精神疾病(如抑郁癥、癡呆、雙相情感障礙和精神分裂癥)導致殘疾的主要原因。這些疾病影響了數億患者,嚴重損害了他們的日常生活質量和心理健康,甚至在某些情況下導致死亡和自殺。
抑郁癥和認知缺陷通常與單胺類神經遞質通路失調有關。盡管一線臨床藥物在控制這些疾病方面有效,但它們面臨諸多挑戰,包括起效慢、療效有限、副作用、停藥后癥狀反彈和藥物依賴等,這些問題導致患者依從性差。此外,藥物通過腸道屏障和血腦屏(BBB)的效率低下,使藥物開發變得困難。當前研究重點是神經保護療法,其副作用或不良反應較少。抗炎和抗氧化作用可以上調腦源性神經營養因子(BDNF),這對大多數抑郁癥和認知缺陷患者有效,但對嚴重病例療效有限。
研究者發現,與直接產生快感的多巴胺受體激動劑和多巴胺轉運蛋白拮抗劑不同,通過調節受體敏感性來平衡突觸神經遞質水平的方法可以改善患者情緒,治療焦慮、抑郁、認知缺陷和藥物成癮。然而,長期研究表明,某些藥物如氯胺酮、安非他明、嗎啡和可卡因具有成癮性和不安全性。在實際應用中,多巴胺D2受體拮抗劑對藥物成癮有一定效果,常與抗抑郁藥聯合使用。先前研究表明,D2受體影響多巴胺的儲存和更新,但受體上調效果起效慢且僅對年輕患者有效,因突觸可塑性有限,不適用于臨床治療。此外,血腦屏障阻礙了外周D2受體拮抗劑(如多潘立酮和甲氧氯普胺)進入大腦。因此,許多研究轉向修改藥物以迅速影響突觸結構并易于通過血腦屏障,如致幻劑和成癮性藥物,旨在實現安全性和療效的平衡。
鐵作為酪氨酸羥化酶和多巴胺受體D2的重要組成部分,與焦慮、抑郁和認知缺陷等癥狀密切相關。研究表明,某些非貧血個體通過長期補鐵可以改善認知功能,鐵缺乏的患者認知能力較差,表明腦鐵水平與認知缺陷相關。目前,臨床鐵補充主要通過口服或注射,但鐵難以穿過血腦屏障,使得補充腦鐵幾乎不可能而不干擾血清鐵循環。此外,傳統鐵補充劑起效慢。因此,需要開發一種安全有效的腦鐵補充劑,使患者能夠自行服用。
基于上述考慮,研究者從中世紀貴族常用的鼻煙壺中獲得靈感,開發了一種新的光學和磁響應鼻腔藥物遞送系統,稱為CFs@DP。該系統由碳化MIL-100(Fe)框架(CFs)和多潘立酮(DP)組成,具有五大優點:便捷的藥物遞送:CFs@DP可以自我封裝多巴胺并與嗅覺多巴胺通路中的受體結合,通過嗅覺神經進入大腦,避免胃腸道不良反應。主動靶向能力:CFs@DP在磁場的幫助下可以進入大腦的病變區域。生物安全性:DP對D2受體的阻斷作用有助于減少鐵對神經元的氧化毒性,DP不會逆向穿過BBB,避免全身副作用。可控釋放能力:在近紅外(NIR)照射和兒茶酚胺誘導的絡合刺激下,CFs@DP可以分解釋放鐵離子和DP。突觸重塑能力:CFs@DP通過多巴胺受體上調實現治療效果,降低成癮、依賴等副作用風險。
在體內實驗中,D1-D2異二聚體和D1R下游信號通路在抗抑郁樣和認知增強效果的機制中起主要作用。在治療階段,DP與突觸前/突觸后膜上的D2受體結合,促進多巴胺的儲存、更新和釋放,激活AC/cAMP/CREB信號通路,上調BDNF產生抗抑郁樣效果。停藥后,激活的PLC/IP3/Ca2+/CaMKII信號通路上調CaMKII/CREB/BDNF,通過調節突觸可塑性和上調BDNF產生抗抑郁樣和認知增強效果。CFs@DP能夠快速改變多巴胺受體和突觸結構密度,而不會直接產生強烈快感,從而為治療藥物成癮開辟了新的可能性。
總之,這項研究開發了一種通過鼻腔遞送藥物的新方法,可以更快、更有效地治療抑郁癥和認知障礙,同時副作用少,不易上癮,有望為患者帶來更好的治療體驗。
抑郁癥和認知缺陷已經成為許多精神疾病(如抑郁癥、癡呆、雙相情感障礙和精神分裂癥)導致殘疾的主要原因。這些疾病影響了數億患者,嚴重損害了他們的日常生活質量和心理健康,甚至在某些情況下導致死亡和自殺。
抑郁癥和認知缺陷通常與單胺類神經遞質通路失調有關。盡管一線臨床藥物在控制這些疾病方面有效,但它們面臨諸多挑戰,包括起效慢、療效有限、副作用、停藥后癥狀反彈和藥物依賴等,這些問題導致患者依從性差。此外,藥物通過腸道屏障和血腦屏(BBB)的效率低下,使藥物開發變得困難。當前研究重點是神經保護療法,其副作用或不良反應較少。抗炎和抗氧化作用可以上調腦源性神經營養因子(BDNF),這對大多數抑郁癥和認知缺陷患者有效,但對嚴重病例療效有限。
研究者發現,與直接產生快感的多巴胺受體激動劑和多巴胺轉運蛋白拮抗劑不同,通過調節受體敏感性來平衡突觸神經遞質水平的方法可以改善患者情緒,治療焦慮、抑郁、認知缺陷和藥物成癮。然而,長期研究表明,某些藥物如氯胺酮、安非他明、嗎啡和可卡因具有成癮性和不安全性。在實際應用中,多巴胺D2受體拮抗劑對藥物成癮有一定效果,常與抗抑郁藥聯合使用。先前研究表明,D2受體影響多巴胺的儲存和更新,但受體上調效果起效慢且僅對年輕患者有效,因突觸可塑性有限,不適用于臨床治療。此外,血腦屏障阻礙了外周D2受體拮抗劑(如多潘立酮和甲氧氯普胺)進入大腦。因此,許多研究轉向修改藥物以迅速影響突觸結構并易于通過血腦屏障,如致幻劑和成癮性藥物,旨在實現安全性和療效的平衡。
鐵作為酪氨酸羥化酶和多巴胺受體D2的重要組成部分,與焦慮、抑郁和認知缺陷等癥狀密切相關。研究表明,某些非貧血個體通過長期補鐵可以改善認知功能,鐵缺乏的患者認知能力較差,表明腦鐵水平與認知缺陷相關。目前,臨床鐵補充主要通過口服或注射,但鐵難以穿過血腦屏障,使得補充腦鐵幾乎不可能而不干擾血清鐵循環。此外,傳統鐵補充劑起效慢。因此,需要開發一種安全有效的腦鐵補充劑,使患者能夠自行服用。
基于上述考慮,研究者從中世紀貴族常用的鼻煙壺中獲得靈感,開發了一種新的光學和磁響應鼻腔藥物遞送系統,稱為CFs@DP。該系統由碳化MIL-100(Fe)框架(CFs)和多潘立酮(DP)組成,具有五大優點:便捷的藥物遞送:CFs@DP可以自我封裝多巴胺并與嗅覺多巴胺通路中的受體結合,通過嗅覺神經進入大腦,避免胃腸道不良反應。主動靶向能力:CFs@DP在磁場的幫助下可以進入大腦的病變區域。生物安全性:DP對D2受體的阻斷作用有助于減少鐵對神經元的氧化毒性,DP不會逆向穿過BBB,避免全身副作用。可控釋放能力:在近紅外(NIR)照射和兒茶酚胺誘導的絡合刺激下,CFs@DP可以分解釋放鐵離子和DP。突觸重塑能力:CFs@DP通過多巴胺受體上調實現治療效果,降低成癮、依賴等副作用風險。
在體內實驗中,D1-D2異二聚體和D1R下游信號通路在抗抑郁樣和認知增強效果的機制中起主要作用。在治療階段,DP與突觸前/突觸后膜上的D2受體結合,促進多巴胺的儲存、更新和釋放,激活AC/cAMP/CREB信號通路,上調BDNF產生抗抑郁樣效果。停藥后,激活的PLC/IP3/Ca2+/CaMKII信號通路上調CaMKII/CREB/BDNF,通過調節突觸可塑性和上調BDNF產生抗抑郁樣和認知增強效果。CFs@DP能夠快速改變多巴胺受體和突觸結構密度,而不會直接產生強烈快感,從而為治療藥物成癮開辟了新的可能性。
總之,這項研究開發了一種通過鼻腔遞送藥物的新方法,可以更快、更有效地治療抑郁癥和認知障礙,同時副作用少,不易上癮,有望為患者帶來更好的治療體驗。
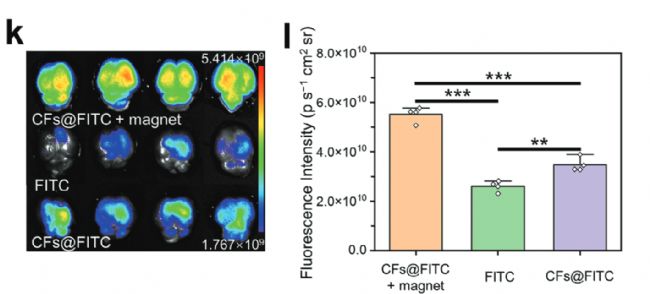
小鼠腦部熒光信號和定量結果
研究中,使用了廣州博鷺騰生物科技有限公司AniView多模式動物活體成像系統,進行了組織器官熒光成像,觀察CFs的入腦能力。上圖所示,與FITC單獨給藥相比,CFs @ FITC表現出更優異的腦滲透性,表明CFs可以通過鼻腔給藥作為載體進入大腦。

論文鏈接:
https://doi.org/10.1002/adma.202405547
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





