Nature Medicine文獻綜述: 人類單細胞圖譜對醫學的重大影響

疾病的發生歸根結底是由細胞狀態的改變和細胞生態系統異常導致的,而這種改變或異常又受到遺傳因素和環境因素的驅動。為了深入理解疾病發生機制,尋求監測和治療的精準手段,在過去的幾十年時間里,人們一直嘗試以更大規模、更精密尺度和更高分辨率來探究細胞內部信息。單細胞技術通過識別特定的細胞類型、狀態、信號表達和傳遞程序,獲得與疾病、發育相關的基因信息,幫助人類突破組織的限制。在細胞水平上理解復雜疾病患病機制,提高臨床診斷分辨率,并使得大規模并行藥物研發成為可能。
一、深入解析復雜疾病的患病機制
遺傳變異,無論是常見或是罕見突變,都可能增加疾病風險。人類遺傳學發展至今已經確定了超過10萬種與不同人類特征相關的遺傳變異。加之2000年完成的人類基因組計劃,以及2012年千人基因組計劃,已經整合完成了人類基因組遺傳變異圖譜,在DNA層面對基因突變與疾病風險有了深入了解。但對于常見突變和罕見突變對疾病的具體貢獻,仍然存在諸多疑問。近年來,研究者們利用全基因組關聯分析(GWAS)技術,通過尋找人類基因組上突變頻率超過5%的位點與研究對象表征之間的聯系,來解釋遺傳位點與常見疾病的關聯性。然而,即使是在常見的復雜疾病中,GWAS表型關聯研究的候選位點也常常位于非編碼區,這對解析目標蛋白編碼基因與功能細胞關聯性帶來了新的困難。此外,人們還發現具有相似臨床表型的常見病和罕見病可能是不同基因變異的結果,即使是同一基因,在不同組織和細胞類型中、不同疾病發展期也可能具有差異性功能,通過傳統技術識別這些基因在通路或細胞水平上的共同作用機制極具挑戰。
單細胞測序的出現為人類觀察細胞帶來了全新的視角。2017年啟動的人類細胞圖譜(Human Cell Atlas,HCA)計劃從單個細胞的層面描繪健康人體微觀細胞參考圖(圖1),通過單細胞測序等新型工具,對所有細胞類型及其亞型進行編目。基于“單細胞圖譜+GWAS”的技術聯用分析模式已應用于多種疾病,包括各種炎癥、自身免疫、神經退行性病變、呼吸系統纖維化和其他復雜疾病。通過對比相關組織的健康和疾病單細胞圖譜,篩選出特定細胞亞群中疾病基因相關的候選位點,揭示了令人意想不到的基因-突變聯系。例如,疾病狀態下,細胞組成和細胞內部基因表達變化可以在多種組織之間串擾,導致疾病中多細胞群落的轉移,將克羅恩病患者回腸中的細胞組成與健康參考圖譜相比較,發現了一個獨特的免疫和基質細胞多細胞群落,這預示著患者可能對anti-TNF藥物治療缺乏響應。將廣泛的潰瘍性結腸炎(UC)的GWAS數據與單細胞圖譜數據相結合,能夠通過GWAS識別表達與UC相關基因的關鍵細胞類型,包括在健康結腸中極其罕見但在發炎、病變結腸中顯著擴張的上皮M樣細胞。對于大多數風險變異位于非編碼區的疾病,綜合GWAS、單細胞圖譜和DNA數據,以及單細胞中DNA和RNA的聯合圖譜,可幫助促進疾病-基因-突變之間的關聯分析,這些進展都為全面闡釋復雜疾病遺傳位點對人類健康的影響提供了幫助。
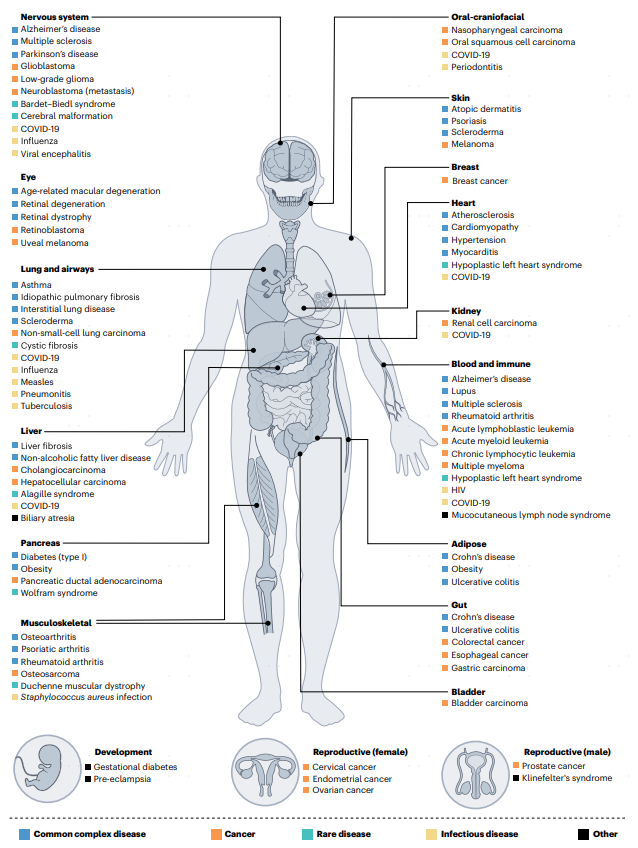
圖1 HCA已收集到廣泛的器官和疾病組織的單細胞圖譜。
上圖展示健康組織中關鍵器官和系統(粗體),以及與不同組織相關的常見復雜疾病(藍色)、腫瘤(橙色)、罕見疾病(綠色)、傳染性疾病(黃色),或其他問題(黑色)。
對身體中所有細胞類型及其在疾病中作用的相關知識,可以重塑臨床診斷工具的未來。例如全血細胞計數(CBC),是一種適用于各種診斷場景的常見臨床指標。在此基礎上,單細胞圖譜技術可以幫助我們進一步精細描述外周血液免疫細胞景觀,提供解釋治療反應和預后的更多信息,為更精準的診斷分析奠定基礎。此外,單細胞圖譜技術聯合組織病理學,有望將傳統的H&E染色技術升級至H&E2.0技術。在未來H&E2.0的版本中,臨床醫生可以將單細胞轉錄組數據、空間轉錄組數據輪廓加載在一張標準組織切片H&E染色圖上,通過統一基因組學和組織學信息輔助診斷,甚至可以通過針對空間數據的機器學習算法模型構建來預測H&E染色樣本的分子輪廓。隨著“基因組學+表觀基因組學+轉錄組學+蛋白組學空間大圖譜”聯合技術在健康和疾病組織中的應用日益增多,通過算法已經可以將低分辨率數據轉換為單細胞分辨率數據,投射在未做過基因檢測的樣本空間結構上,并在類似組織中恢復其空間分子特征。如果有足夠的數據,未來算法還可以將分子圖譜和組織病理學結果相互映射,以期改進對單個患者診斷結果的準確性。
三、對高分辨率大規模并行藥物研發的助力
健康人群單細胞圖譜的完善和空間基因組學技術的發展,為提高分辨率篩選表型相關分子藥物開辟了新的道路。通過單細胞轉錄組測序數據篩選及單細胞基因集合篩選,可以獲得大量與疾病相關的基因、與常見復雜疾病相關的非編碼變異體,以及與癌癥和發育障礙相關的突變位點,并且可以大幅縮短治療靶點的甄選過程。近年來,基于單細胞測序的靶向小分子篩選技術也已經在研發中。隨著圖譜數據和單細胞數據量的積累,目前機器學習算法已經可以預測在相同細胞環境中,一個或多個基因擾動對疾病模型的影響,構建并在新生物環境中響應相同擾動的疾病模型。
在再生醫學和細胞治療領域,單細胞測序技術也正承擔起越來越重要的角色。單細胞圖譜增強了我們對健康人體細胞應有基因表達模式的理解,更好的定義了工程細胞構建需要達到的目標。在構建人類器官衍生模型的時候,疾病參考圖譜和健康對照圖譜幫助研究者們更好的匹配模型和人類組織,識別模型缺失的細胞成分,并改進預測模型的分子機制。目前研究者已將單細胞測序應用于篩選帕金森病治療模型、含有自閉癥相關基因突變的大腦類器官模型、子宮內膜或腸道的類器官模型。此外,對于體內組織重編程,參考單細胞圖譜有助于推斷分化機制和評估治療是否達到預期效果。對于功能細胞治療,單細胞測序有助于明確產生療效所需的細胞狀態,以及監測患者給藥前后細胞狀態的變化,這在癌癥的工程細胞治療領域極具吸引力。
展望:單細胞圖譜在生物醫學上面臨的挑戰
為了實現細胞圖譜在醫學中的變革潛力,我們仍需克服技術、實用和基礎方面的各項重大挑戰。首先,雖然近年來在HCA計劃的支持下,研究者們匯集了人類進化史上從祖先到地理多樣性的健康和疾病細胞圖譜集,但是相比構成人體的200多種數萬億細胞,我們現有的數據資源依然十分有限。
其次,實驗室和臨床之間的聯系也需要進一步加強。包括建立更多具有豐富元數據資源的生物庫,實現從多種臨床隊列中進行大規模樣本分析。以及尋求更好的樣本保存方法解決常規樣本保存方法,如福爾馬林固定和石蠟包埋樣本與單細胞技術兼容的問題。
再次之,單細胞數據分析上關鍵的挑戰是需要更多能反映人類多樣性的開放數據,通過訓練計算模型,開發從靜態圖譜到細胞動力學的解碼方法,建立高效檢索流程,通過算法平臺找到我們感興趣的基因、細胞裝填和細胞類型。
最后,盡管從實驗室到臨床應用領域或藥品生產環節上,傳統表達譜分析能夠獲得分子機制與疾病治療的潛在關聯,但是證明基因、信號通路、細胞狀態在疾病中的作用仍然需要更為直接的證據,單細胞+空間基因組學+遺傳篩選的臨床隊列實驗將有助于實現我們對疾病的理解從相關性到因果性的質的飛躍。
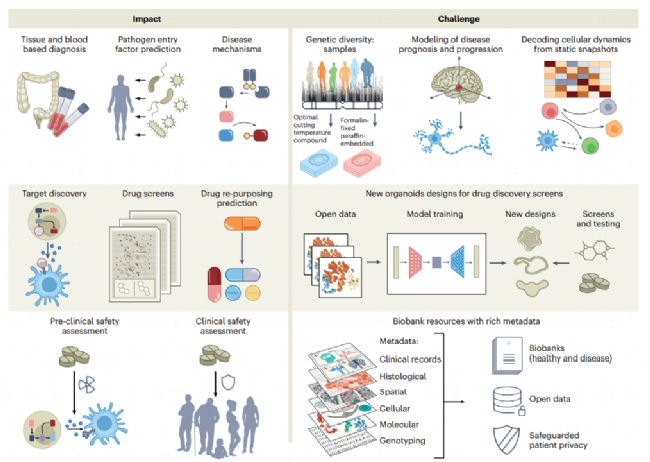
圖2 人類細胞圖譜的潛在醫學影響和面臨的挑戰。
左圖,從細胞圖譜中得出的關于疾病機制、診斷和治療的重要見解。右圖,影響醫療的關鍵技術和基本障礙,包括多樣性、數據可用性和了解疾病進展
結論
單細胞圖譜和空間圖譜的不斷完善,加深了人類從細胞和組織水平上對不同疾病的深入理解,逐步為診斷、藥物發現和新的治療途徑發展提供助力,相關實驗技術和計算算法的興起推動了生物醫學各個階段的研究,包括從理解疾病機制到診斷和治療疾病。近年來,隨著測序、細胞操作和空間技術在樣本規模、分辨率上的迅速增長以及技術成本的逐步下降,使得采集臨床醫學所需的跨性別、年齡、血統和人口的不同參考單細胞圖譜成為可能,這些將有助于形成一份更加全面的細胞圖譜,作為理解人類健康以及診斷、監測和治療疾病的基礎,實現人類細胞圖譜計劃的最終使命。
單細胞測序一直以來成為各大期刊,包括CNS等頂流期刊的連續關注,如今Nature Medicine一文向我們解釋了單細胞圖譜為疾病領域的機制研究開辟了新的道路,并影響醫學的各個方面,這一炙手可熱的技術在細胞和基因水平破譯疾病的機制,監測疾病的進展和特征,發現和開發新的生物標志物或細胞療法,為診斷、藥物發現和新治療途徑的發展提供信息。
參考文獻
Rood J. E., et al., Impact of the Human Cell Atlas on medicine. Nat Med. 2022 Dec 8. doi: 10.1038/s41591-022-02104-7.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





