類器官模型助力Nature:熊脫氧膽酸有望成新冠特效藥或將終結新冠時代
百趣代謝組學文獻分享:2022年即將過去,隨著疫苗的全面接種和三年以來“動態清零”的堅持,我們在應對新冠病毒如潮水般的攻擊中取得了階段性成果。雖然大家陸陸續續投入到正常的工作生活中,但是我們都知道新冠并未被“打敗”,“戰爭”也并未過去。近日,Nature在線發表題為的“FXR inhibition may protect from SARS-CoV-2 infection by reducing ACE2”論文,表明熊脫氧膽酸或許有望成為新冠特效藥。

這場新冠戰役,人類或許迎來了真正的曙光!
接下來,百趣代謝組學小趣將這篇重磅新文,給大家做一個深入淺出的解讀。
自從三年前新冠病毒首次被發現以來,因為其可怕的毒性以及強大的傳播性,對人類公共安全帶來了極大的威脅。目前為止除了疫苗之外,人類缺少更為有效的病毒防御策略,即便是疫苗也存在著病毒不斷變異導致其防御能力降低的風險,以及嬰幼兒和老人抵抗力弱,疫苗無法很好的發揮作用等問題,所以新冠的特效藥研發一直是全世界科學家夜以繼日研究的重點。
我們知道新冠病毒(SARS-CoV-2)入侵人體細胞的方式,主要是通過其刺突上的受體結合域與人體細胞表面的血管緊張素轉化酶(angiotensin converting enzyme 2, ACE2)相結合,進而穿透細胞膜進入人體細胞。
正所謂遇到問題,消滅問題,面對病毒的侵襲,人們第一時間想到的自然是消滅病毒,然而因為病毒結構簡單,極易變異等特點,人類在消滅病毒的戰爭中從未真正消滅過病毒。所以我們不如換個思路,既然消滅不掉病毒,那就消滅掉病毒的入侵途徑,只要病毒無法進入體內,那病毒到底有多少也就無所謂了。
本文就是運用這樣的思路,找到了抑制ACE2靶點的關鍵藥物—熊脫氧膽酸。
1.ACE2的表達需要依賴膽汁酸的調節
為了探索ACE2的表達機制,作者選擇了體內ACE2表達量最高的膽管細胞構建體外模型,為了更好地模擬細胞在體內面對SARS-CoV-2感染更真實的反應,作者選用了類器官模型而非單純的貼壁細胞模型。
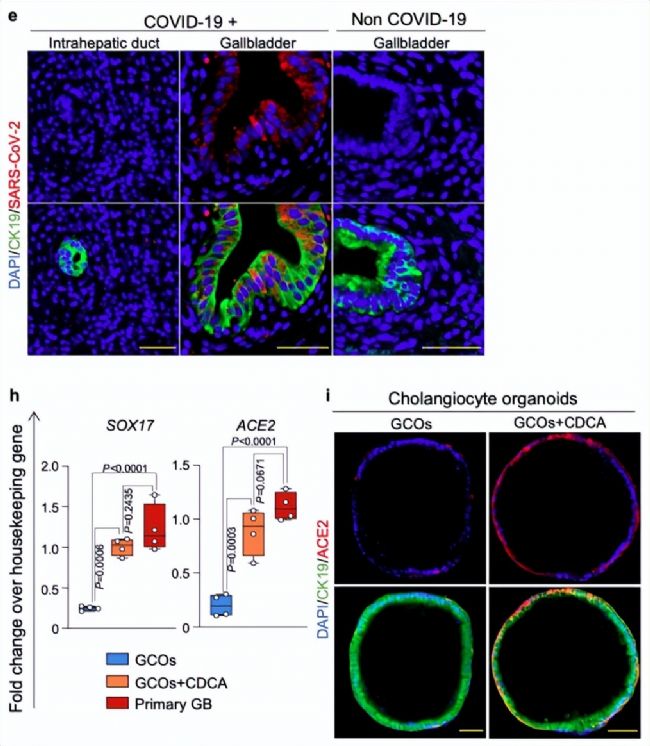
圖1. SARS-CoV-2侵入后相關基因在膽管細胞中的表達
實驗發現,SARS-CoV-2主要攻擊膽囊細胞,在膽管細胞類器官模型中發現,在鵝去氧膽酸(chenodeoxycholic acid, CDCA)條件下,膽管細胞表面的ACE2會高表達。
2.膽汁酸通過FXR控制ACE2水平
因為CDCA是FXR的天然激動劑,因此CDCA很可能通過FXR調控ACE2的表達。作者針對FXR的表達定位,ACE2的表達量進行了實驗分析。
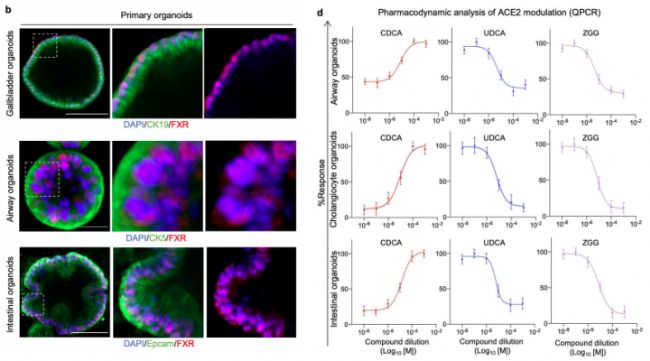
圖2. FXR調節ACE2表達
可以發現,FXR確實在各種膽管細胞的類器官中均有表達,并且使用FXR的抑制劑,如熊脫氧膽酸(ursodeoxycholic acid, UDCA)等處理后,ACE2確實受到FXR被抑制的影響而降低了表達量。
3.FXR在不同細胞中均可以調節ACE2
我們知道,新冠病毒主要攻擊人的肺,腸等器官,如果上述調控機制能夠在體內多個器官中均存在,將具有更重大的臨床意義,正因如此,作者在肺、腸的類器官中做了衍生的研究。
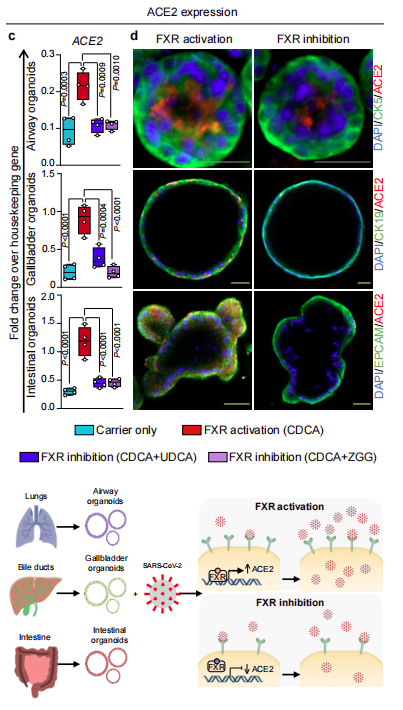
圖3. 不同細胞類器官中FXR調節ACE2的表達
研究發現在不產生細胞毒性的濃度下,無論是FXR的激動劑還是抑制劑(CDCA、UDCA)均會通過影響FXD的活性,而對肺、腸等類器官中的ACE2的表達量產生影響,表明FXR介導的ACE2表達很可能在多種器官中廣泛存在。
4.FXR在體外對新冠病毒感染的調節作用
在證實了早已被廣泛應用到臨床中使用的藥物:UDCA可以通過抑制FXR的信號傳導進而降低ACE2的表達量這一現象后,讓我們回到問題的關鍵,我們終究要解決的是SARS-CoV-2的感染問題,那調節了FXR是否就能降低SARS-CoV-2的感染作用呢?
作者將膽管細胞、呼吸道細胞和腸道細胞的類器官暴露于生理濃度的CDCA環境下,模擬體內FXR正常激活環境,并使用新冠患者鼻咽拭子分離出來的SARS-CoV-2進行感染處理。
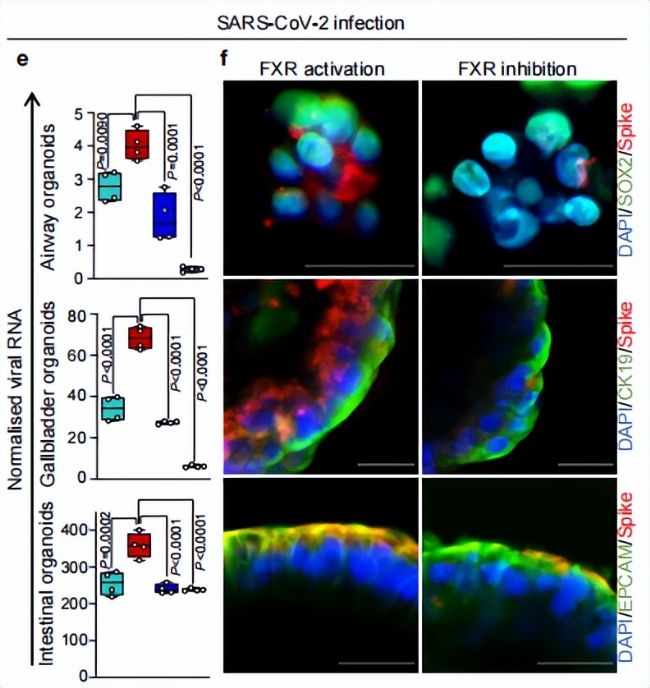
圖4. 各種類器官中SARS-CoV-2刺突蛋白表達情況
SARS-CoV-2在不同類器官上的免疫組化染色以及核酸表達量數據均表明,抑制FXR活性會顯著降低SARS-CoV-2病毒的感染。
5.FXR對病毒感染調節的體內實驗
緊接著體外模型的下一步,作者在倉鼠模型中開始了體內實驗的驗證。
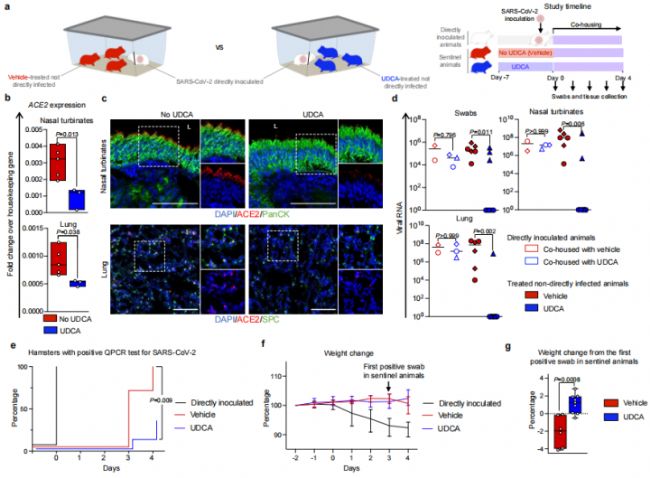
圖5. FXR抑制ACE2和SARS-CoV-2體內感染的研究
從圖5b.c可以發現,經過UDCA治療后的倉鼠鼻腔和肺組織中ACE2的表達量均顯著降低。將UDCA治療的倉鼠和對照組分別與SARS-CoV-2感染的倉鼠同籠,以評估UDCA治療對SARS-CoV-2傳染的防御作用,可以發現4天同籠處理之后,對照組所有6只倉鼠均罹患SARS-CoV-2(感染率100%),而UDCA治療組的9只倉鼠則有6只幸免遇難,感染率僅33%(圖5.e)。表明UDCA在體內實驗中依然展現了顯著的COVID19防御力。
6.FXR調節人體器官感染
在類器官模型和動物模型上都發現了可喜的結果,更振奮了作者的信心,作者進一步使用體外常溫灌注(ex situ normothermic perfusion, ESNP)技術,研究肺器官在SARS-CoV-2感染下的反應。ESNP技術簡單來說就是一套體外維生系統可以讓器官在體外進行保存并保持生理活性[1]。本研究中將來自同一個供體的肺左右分開,置于相同條件的ESNP下,分別給予 2000 ng/ml的UDCA(相當于患者口服多次UDCA后達到的穩態血漿濃度)和等量的生理鹽水。
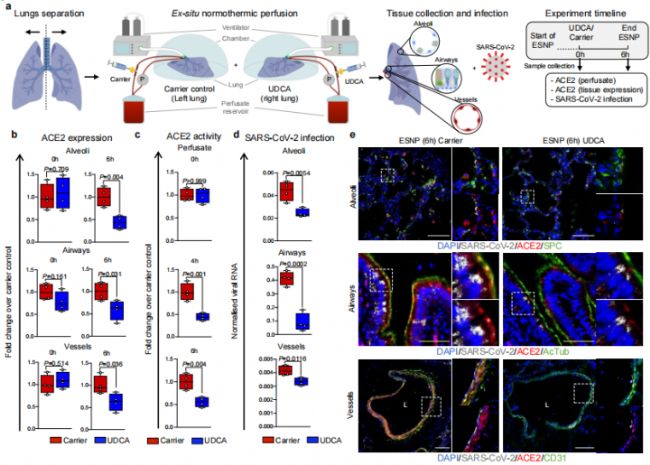
圖6.體外抑制FXR可降低ACE2水平和SARS-CoV-2感染
結果表明,UDCA處理后,能夠減低肺實質、氣管等組織部位中ACE2的表達量,并且能夠降低SARS-CoV-2的感染。同樣的在體外肝樣本中也呈現了類似的結論。
7.UDCA可能會改善新冠肺炎的成果
鑒于UDCA良好的安全性,以及悠久的用藥史,作者招募了志愿者實際測試了UDCA的治療效果,志愿者進行了15mg/Kg/day的UDCA治療,并在治療前、治療期間以及治療后分別采集了志愿者的鼻黏膜上皮細胞(鼻黏膜上皮細胞是SARS-CoV-2感染的主要部位),實驗發現UDCA顯著降低了ACE2的轉錄水平,由下圖可以清晰看到,UDCA干預當天志愿者鼻黏膜上皮細胞的ACE2水平就開始降低,并在干預期間始終保持著較低的水平。
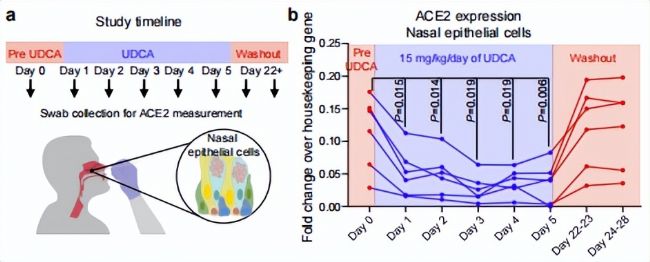
圖7. 鼻咽拭子采集的鼻上皮細胞ACE2水平的QPCR測量
作者通過分析COVID-Hep/SECURE肝臟登記研究數據同樣發現,接受了UDCA治療的患者表現出了更低的住院率、更低的重癥率、更低的死亡率(存在可能的數據偏差)。
小趣總結
作者從類器官、動物模型、立體人體器官、志愿者組織和人群隊列等一系列維度逐步發現驗證了UDCA可以通過FXR,降低ACE2表達,進而阻礙SARS-CoV-2進入人體細胞,產生新冠防御作用。
非常值得注意的是,本文是以類器官模型為起點一步步發現UDCA的治療作用,類器官技術是近年來生物醫學領域最具突破性的前沿技術之一,在2013年就被SCIENCE雜志評為年度十大技術。類器官(Organoids)指利用成體干細胞或多能干細胞進行體外三維(3D)培養而形成的具有一定空間結構的組織類似物。能夠最大程度地模擬體內組織結構及功能并能夠長期穩定傳代培養。
相比傳統的二維培養模型,類器官代表著一種能夠概括整個生物體生理過程的創新技術,具有更接近生理細胞組成和行為的優勢。而與動物模型相比,類器官模型的操作更簡單,且在臨床疾病研究方面,患者同源的類器官能更好地用于研究疾病發生和發展等機理。
百趣生物經過多次實驗驗證成功開發類器官代謝組學,助力疾病研究。
參考文獻:
[1] Clavien P A, Dutkowski P, Mueller M, et al. Transplantation of a human liver following 3 days of ex situ normothermic preservation[J]. Nature Biotechnology, 2022: 1-7.
文獻下載鏈接:
https://pan.baidu.com/s/1SzFrfrjsVe3yG1kIJ0NeTQ
提取碼:0000





