腸道菌群代謝組學的應用:苯乙酸PAA能夠誘發脂肪性肝病
脂肪性肝病(脂肪肝,hepatic steatosis),正嚴重威脅國人的健康,成為僅次于病毒性肝炎的第二大肝病,發病率在不斷升高,且發病年齡日趨年輕化。代謝組學文獻分享,脂肪肝一般分為酒精性脂肪肝和非酒精性脂肪肝兩大類。根據脂肪變性在肝臟累及的范圍,又可分為輕、中、重三型,通常脂肪含量超過肝臟重量的5%~10%時被視為輕度脂肪肝,超過10%~25%為中度脂肪肝,超過25%為重度脂肪肝。這種肝臟疾病通常與肥胖、動脈粥樣硬化、酒精和糖尿病相關[1-5]。一般而言,脂肪肝屬可逆性疾病,早期診斷并及時治療常可恢復正常,比如在臨床上主要應用胰島素增敏劑、調脂藥以及抗氧化劑等治療非酒精性脂肪肝(NAFLD)。
據估計,三分之一的成年人可能具有早期階段的NAFLD,但在疾病進展之前沒有或者很少有癥狀呈現。代謝組學文獻分享,血液檢查和超聲波掃描這些診斷技術只有在已經存在明顯的肝損傷時才查得到,那時已經延誤了治療時機。

不過,根據發表在《Nature Medicine》上的一項研究,腸道微生物及其芳香族氨基酸代謝物-苯乙酸(phenylacetic acid,PAA)似乎也促進了疾病發展[6],表明有望通過糞便微生物移植來治療,微生物產生的化學副產物有可能被用作疾病的早期預警信號,它們可以用簡單的血檢來檢測。
代謝組學文獻分享,為了深入研究微生物-宿主的相互作用是否促進了疾病發展,英國、西班牙、意大利等地的研究人員招募了105名研究的對象,分別是44名西班牙的婦女和61名意大利的婦女,她們正在醫院準備進行胃旁路手術,以治療肥胖。這些婦女在手術前捐贈了樣本,包括糞便、尿液、血漿和肝臟活檢樣本。所有參與者都被列為病態肥胖,并且沒有病毒性肝炎、癌癥和2型糖尿病。
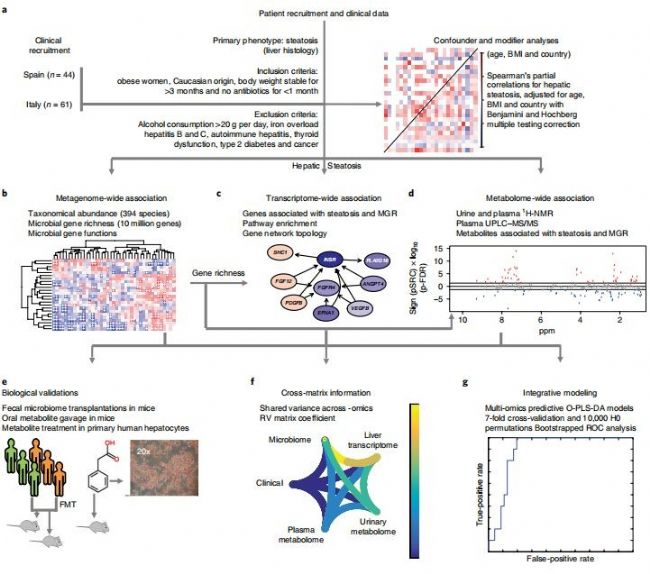
圖 1 項目研究思路
如圖1所示,本研究先對募集的105名研究對象的臨床收集的數據信息通過數據擬合分析發現可能的臨床混雜因素,比如年齡、BMI、國家;然后在進行組學分析的時候盡量使用偏向關系分析pSRC等算法對這些混雜因素校正,接著主要對56個病人進行脂肪肝分型(0、1、2、3期),并進行糞便宏基因組學、肝臟轉錄組學、血漿和尿液(n=102)代謝組學檢測、肝臟脂肪測定、肝臟組織學圖譜及其他脂肪肝相關的臨床指標數據采集,后續進行跨組學關聯分析、疾病診斷分型分析、糞便菌群移植實驗、代謝物-細胞實驗、代謝物-小鼠填喂實驗等表明菌群和代謝物與脂肪肝密切相關。

圖2 宏基因組學MGR與脂肪肝的關聯
代謝組學文獻分享,通過對糞便樣本進行宏基因組學檢測,以微生物基因豐富度(microbial gene richness,MGR)對樣本進行分組,發現樣本平均基因數是558,246 ± 154,249,進而可以劃分為low MGR組和high MGR組。研究發現(圖2a),隨著脂肪肝的疾病發展,對于肝脂肪變性不太嚴重的個體,腸道微生物組中的微生物基因豐富度相對較高,而對于那些嚴重的肝脂肪變性病例,微生物基因豐富度較低;此外,MGR同肝功能相關指標(如γ-glutamyltransferase、alanine amino-transferase and inflammation (C-reactive protein))具有顯著性負相關作用(圖2b),與LDL cholesterol、Triglycerides 具有顯著性正相關作用;在微生物門水平上發現Proteobacteria(變形菌門)、Actinobacteria(放線菌門) 和 Verrucomicrobia (疣微菌門)與脂肪肝臨床診斷指標具有顯著性正相關作用,而 Firmicutes(厚壁菌門)和Euryarchaeota (廣古菌門)與脂肪肝臨床診斷指標具有負相關作用。研究中還發現肝臟疾病似乎與腸道微生物組中某些基因功能的存在相一致,包括脂肪酸合成、糖代謝、支鏈氨基酸或芳香族氨基酸的代謝通路(圖3)。
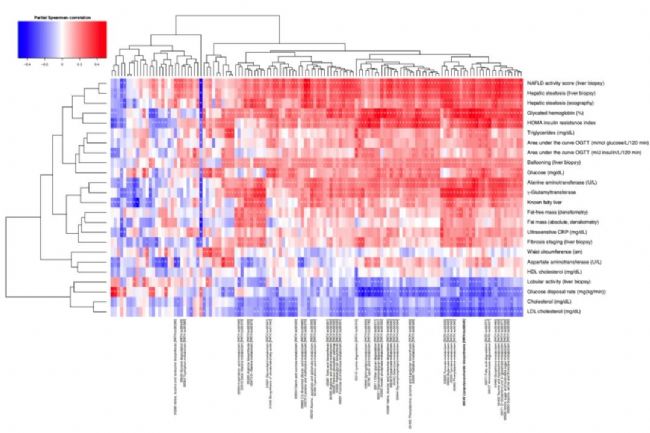
圖3 腸道菌群功能模塊與臨床指標的偏相關結果
為了闡述清楚微生物可能作用于脂肪肝形成的靶向物質,該研究采用了核磁非靶向代謝組學和質譜的靶向代謝組學技術對血漿和尿液樣本進行檢測,不同于常規代謝組使用VIP值、Q值、fold-change值的差異物統計分析,而采用偏相關系數進行代謝物與脂肪肝臨床指標的分析(圖4),對血漿和尿液都分別通過2次對比:1)疾病分型;2)菌群MGR分型,找到2種分組下與臨床指標關聯代謝物(校正后P值<0.05的代謝物就是與臨床指標密切關聯的代謝物,如圖4中紅色和藍色的點)。代謝組學文獻分享,血漿和尿液中分別發現80和124個代謝物與脂肪肝臨床指標具有顯著性關聯。如圖5所示,血漿和尿液樣本中的支鏈氨基酸(亮氨酸、異亮氨酸、纈氨酸)在脂肪肝患者中都出現顯著性變化,此外還發現菌群參與苯丙氨酸代謝的副產物-苯乙酸PAA 與脂肪肝臨床表型具有最強的顯著性關聯(p-FDR=4.69×10−5),所以后續可對PAA代謝物進行細胞和小鼠造模的功能性研究。
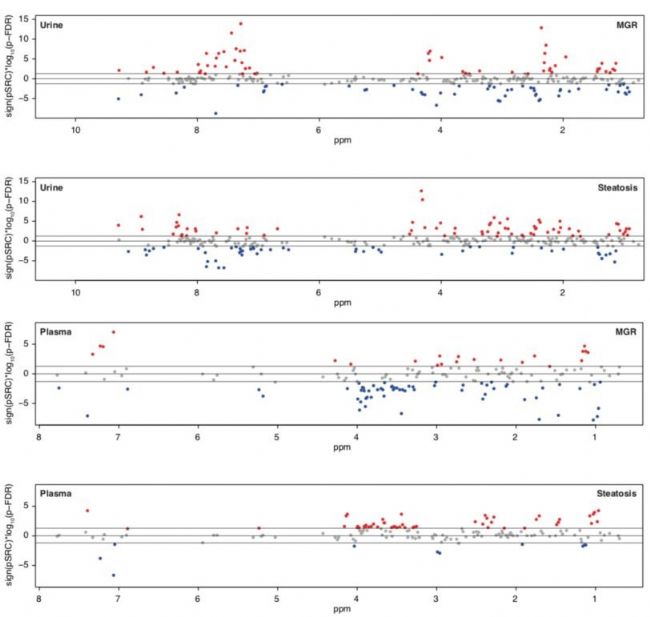
圖4 代謝組學研究與脂肪肝臨床指標的偏相關結果
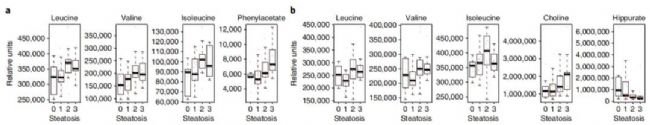
圖5 與脂肪肝和微生物相關的代謝物
上述結果表明脂肪肝患者的腸道菌群和代謝物出現了顯著性變化,為了揭示腸道菌群是否會影響肝臟代謝變化,對肝臟組織進行了轉錄組學檢測。如圖6所示,按照MGR豐富度高低進行分組,發現了2277個基因與脂肪肝和low MGR有關聯,pathway的富集分析表明主要是病毒細菌類的免疫應答、胰島素耐受(如胰島素受體表達基因INSR表達降低)等方面具有顯著性差異。代謝組學文獻分享,此外,脂蛋白脂肪酶基因LPL表達增高,長短鏈乙酰輔酶A脫氫酶基因ACADSB表達降低可能與脂類物質堆積與密切關系。上述結果將腸道菌群參與的支鏈氨基酸和芳香族氨基酸代謝、血漿和尿液中的支鏈氨基酸和芳香族氨基酸副產物、肝臟的胰島素受體和脂類合成基因轉錄表達與胰島素耐受、脂肪肝、low MGR的關系聯系在一起。
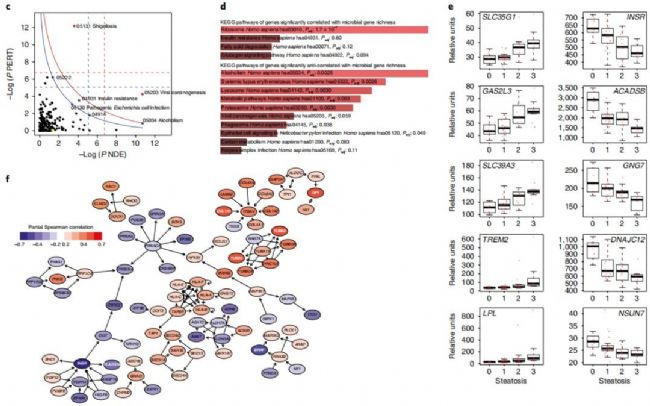
圖6 肝臟組織的轉錄組學研究
多組學研究發現腸道菌群參與的支鏈氨基酸代謝、芳香族氨基酸代謝與脂肪肝的形成具有一定的關聯,為了更加確定因果關系,從人類捐贈者轉移腸道細菌導致小鼠發育脂肪肝,表明腸道菌群構成的變化在該疾病中發揮作用。代謝組學文獻分享,其中移植的人體腸道菌群數據通過使用SIMCA軟件的OPLS回歸模型,能夠較好地預測小鼠的表型變化,主要體現在肝臟甘油三酯水平、Fabp4基因表達和血漿的纈氨酸水平(如圖7所示)。
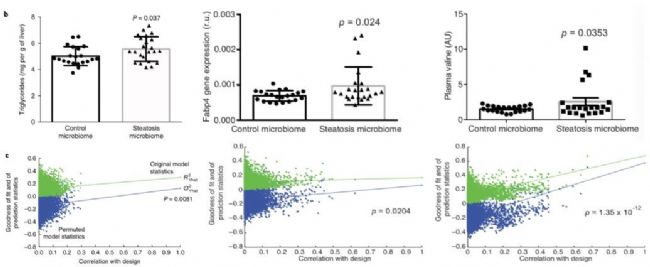
圖7 OPLS模型進行表型預測
除了對腸道菌群進行糞菌移植實驗證明腸道菌群在脂肪肝發病中的重要作用,該研究還對微生物代謝物苯乙酸PAA進行細胞和小鼠的功能試驗驗證。棕櫚酸(palmitic acid,PA)被報導能夠誘導人體原代肝細胞出現脂肪累積,因此以PA作為陽性對照,使用PAA進行原代肝細胞飼養,從圖8a中可以清楚發現PAA和PA一樣能夠促進細胞的脂肪堆積,還發現基因表達與上述的研究具有一定的趨同性,比如LPL(脂蛋白降解酶)和FASN(脂肪酸合成基因)表達量高,表明原代肝細胞的脂類合成能力增強;INSR(胰島素受體基因)表達增高,GLUT2(葡萄糖轉運蛋白2)表達降低,且胰島素信號中的磷酸化蛋白表達量低,細胞仍處于胰島素耐受狀態。PAA物質的小鼠灌胃實驗表明PAA能夠增加小鼠肝臟的甘油三酯,降低小鼠尿液異亮氨酸的排泄量(圖8l-m)。
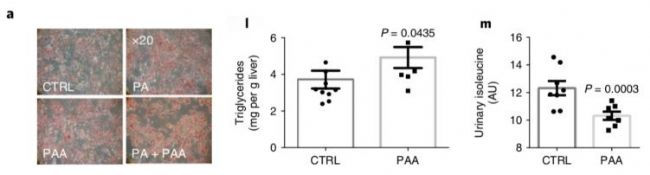
圖8 微生物代謝物-苯乙酸PAA的細胞和小鼠造模實驗
為了檢測組學技術能否進行脂肪肝疾病的早期預警和預測,使用SIMCA軟件中的OPLS-DA數據模型對脂肪肝患者進行臨床診斷分析,其中將脂肪肝0期的樣本作為一組,將脂肪肝1期、脂肪肝2期、脂肪肝3期的樣本作為一組,樣本數是10 VS 46。如圖9所示,使用無創臨床指標數據進行疾病診斷分析,AUC=58.38%;加上微創的血糖檢測指標(如oral glucose tolerance tests 和 EHCs),AUC=68.69%;這些疾病判斷結果明顯低于組學技術最弱的診斷結果(尿液代謝組AUC=69.39%)。代謝組學文獻分享,以肝臟的轉錄組學診斷結果為參考,在單一組學上可以發現血漿代謝組(AUC=79.60%)和糞便宏基因組(AUC=72.73%)比尿液代謝組具有更好的預測能力,三個組學合并具有最高的疾病診斷能力(AUC=87.07%)。
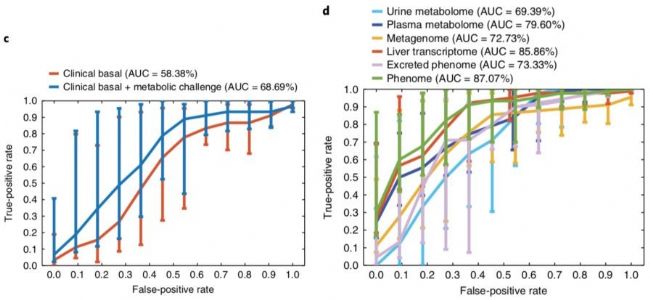
圖9 OPLS-DA模型的疾病診斷分析
綜上所述:
1. 研究分析女性脂肪肝患者的糞便宏基因組、分子表型組(肝轉錄組、血漿和尿液代謝組)和臨床表型;
2. 發現脂肪肝患者腸道菌群基因豐富度低,菌群的膳食脂質代謝、內毒素、芳香族和支鏈氨基酸的生物合成能力增強;
3. 與菌群結果一致的是患者的代謝組特征,而且肝臟免疫炎癥等基因表達增強;
4. 糞菌移植實驗表明腸道菌群可引發脂肪肝,長期苯乙酸(PAA,菌群芳香族氨基酸代謝產物)攝入也有相似作用;
5. 基于分子表型組學和宏基因組學的建模可用于預測脂肪肝情況。
然而,研究人員強調,尚不清楚PAA是否與疾病直接相關,或者它們的增加是否與細菌平衡的臨界點相關,還需要進行更多工作來探索這些聯系,看看像PAA這樣的化合物是否確實可以用來鑒別處于危險中的患者,甚至預測疾病的進展,這將為GP診所(一種在英國普遍存在的小診所)進行簡單的篩查試驗提供了一種可能性。代謝組學文獻分享,好消息是,通過操縱腸道細菌,我們可能能夠預防脂肪肝疾病及其并發癥。
參考文獻:
[1] Saltiel, A. R. & Kahn, C. R. Insulin signalling and the regulation of glucose and lipid metabolism. Nature 414, 799–806 (2001).
[2] Kahn, S. E., Hull, R. L. & Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature 444, 840–846 (2006).
[3] Meex, R. C. R. & Watt, M. J. Hepatokines: linking nonalcoholic fatty liver disease and insulin resistance. Nat. Rev. Endocrinol. 13, 509–520 (2017).
[4] Petersen, M. C., Vatner, D. F. & Shulman, G. I. Regulation of hepatic glucose metabolism in health and disease. Nat. Rev. Endocrinol. 13, 572–587 (2017).
[5] Adams, L. A., Anstee, Q. M., Tilg, H. & Targher, G. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut. 66, 1138–1153 (2017).
[6] Hoyles, L., Fernández-Real, J.M., Federici, M. Molecular phenomics and metagenomics of hepatic steatosis in non-diabetic obese women. Nat Med. 24:1070-1080 (2018).
[7] Latorre, J. et al. Decreased lipid metabolism but increased FA biosynthesis are coupled with changes in liver microRNAs in obese subjects with NAFLD. Int. J. Obes. (Lond.) 41, 620–630 (2017).





