CERO動態3D培養在MSCs-GM促進軟骨形成中的應用
在軟骨組織工程和再生醫學領域中,有許多臨床前研究表明干細胞能有效地使損傷軟骨組織恢復功能;另外,逾200例臨床試驗采用干細胞來處理軟骨組織損傷,并研究其應用于病患時的安全性、有效性、長期可行性。其中,有些結果表明治療有效,有些則反之。
MSCs(間充質干細胞)常被選為細胞材料。這是因為它具有多潛能性、安全性,且較少引發免疫反應。有數據顯示,要在臨床中對患者有效治療,需要大量的MSCs(1千萬-1億個細胞)。一些臨床研究采用單層2D細胞堆疊培養以獲取足量的細胞,這種方式需要較長的體外培養周期。很多報告顯示長期體外培養會導致干細胞喪失干性,包括有絲分裂能力、集落形成單位效率。另外,還有報告顯示MSCs隨著培養時間增加會傾向于失去分化為軟骨組織的潛能。這解釋了上述臨床試驗失敗的可能原因。
該試驗在GM(明膠微球)表面接種BMSCs(骨髓間充質干細胞)后,放入CERO中進行3D培養,以期提高細胞產量;另外,采取了動態培養的模式,以期通過機械刺激增加軟骨分化形成。
該試驗使用CERO 3D懸浮培養儀,通過精確的旋轉參數設置,來實現自動化、周期性、間歇性的3D動態懸浮培養。通過CERO的50ml培養管內部的鰭片結構,輕松的實現攪動懸浮,并且極大程度的降低了剪切力,較少細胞損傷。
另外進行了靜態3D培養,也在組織培養平板上進行了培養,來進行對比。下面介紹其實驗過程和結果。
制備GM
采用油包水的方法制備GM,A為干條件下的圖像,B為濕條件下的圖像。D展示了GM的球狀形態和光滑表面。
接種和培養BMSCs
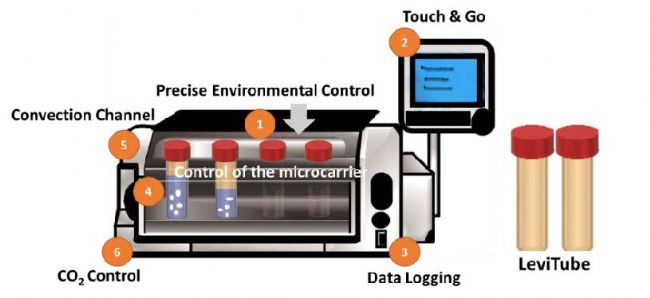
在CERO中通過精確的設置參數,實現自動化的間歇式攪拌,使用FD培養基將BMSCs接種到GM上,獲得BMSCs-GM。
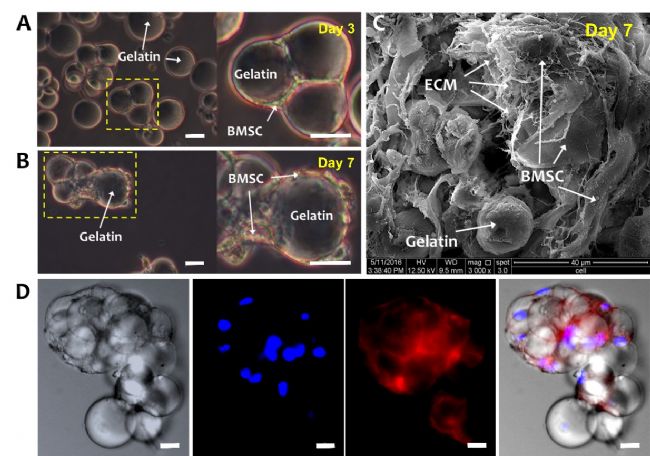
D為第7天的BMSCs-GM的CLSM圖像,用Hoechst染色細胞核,鬼筆環肽-TRITC染色細胞肌動蛋白。A、B、D比例尺均為100μm。
“2D”和“3D”培養的對比
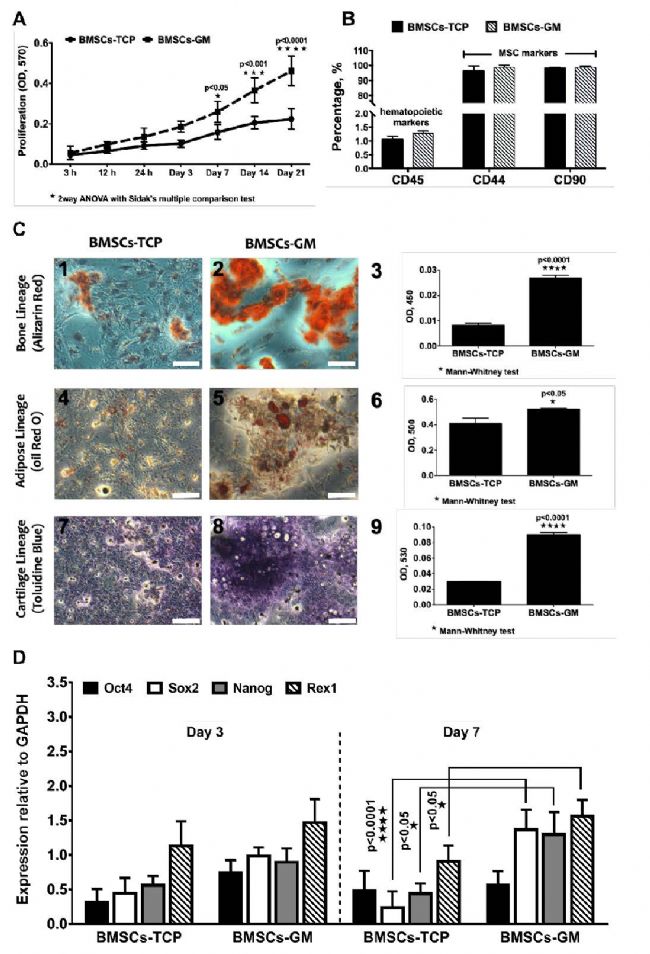
A中可以看出隨著培養時間增加,3D培養(BMSCs-GM)的細胞產量明顯高于2D培養(GMSCs-TCP,組織培養板)。
另外,C中可以看出3D、2D培養都可以分化出三種主要細胞譜系:骨細胞、脂肪細胞、軟骨細胞。比例尺為100μm。
動態、靜態環境下的細胞和ECM
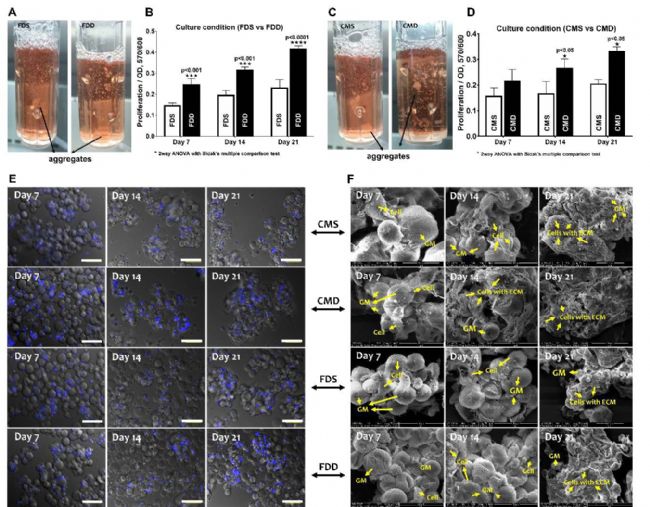
本圖顯示了不同培養基,動態/靜態的差異。簡寫中,前兩字母的CM代表CIM培養基(軟骨誘導培養基),FD代表FD培養基(F12:DMEM=1:1);末尾字母S代表靜態(static),D代表動態(dynamic)。
CERO動態3D培養條件下,細胞和ECM產量明顯高于靜態培養。并且,BMSCs在微球體表面積累了大量ECM蛋白,表明細胞-細胞間聯系、細胞-微球體間聯系均有產生。
E中比例尺100μm;F中比例尺40μm。
軟骨分化對比
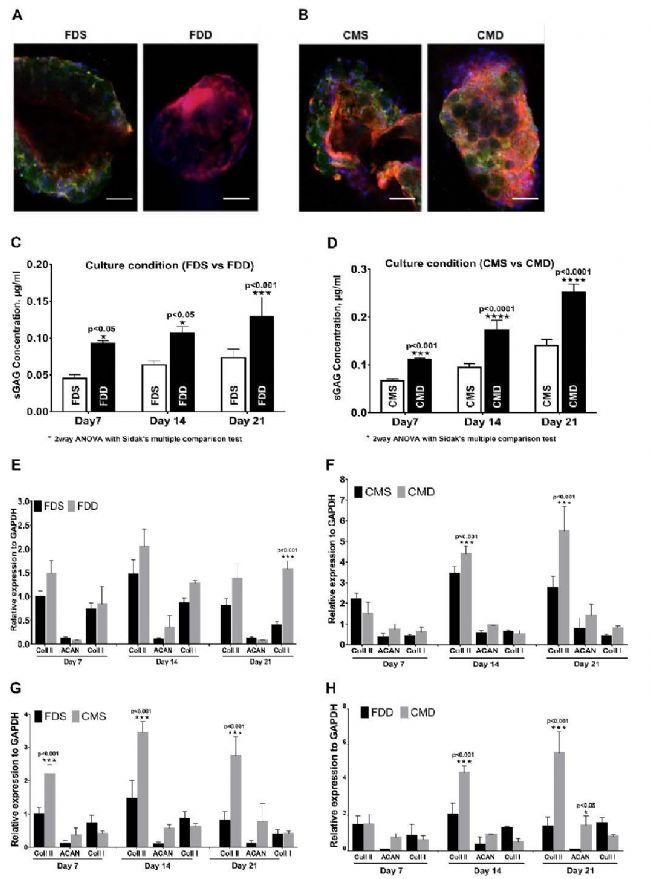
免疫組織化學染色圖像顯示出了II型膠原蛋白的表達,動態培養條件高于靜態培養條件。蛋白多糖亦然。
結語
CERO的3D動態懸浮培養明顯地提升了細胞、ECM產量,且有利于BMSCs的軟骨分化。
文獻:
Sulaiman, S.; Chowdhury, S.R.; Fauzi, M.B.; Rani, R.A.; Yahaya, N.H.M.; Tabata, Y.; Hiraoka, Y.; Binti Haji Idrus, R.; Min Hwei, N. 3D Culture of MSCs on a Gelatin Microsphere in a Dynamic Culture System Enhances Chondrogenesis. Int. J. Mol. Sci. 2020, 21, 2688. https://doi.org/10.3390/ijms21082688





