正畸壓應力促進破骨細胞形成的機制研究
在正畸治療期間,對牙齒施加機械力,導致牙槽骨的持續重塑。破骨細胞在壓力側移除舊骨,而成骨細胞在張力側形成新骨。在機械力誘導的骨重塑過程中,細胞骨架發揮著重要作用,將機械信號轉化為化學信號,然后化學信號再轉導到細胞中,調節分化、增殖、遷移和其他細胞過程。
據報道,多種信號通路參與成骨細胞的機械信號轉導網絡,如磷脂酰肌醇3-激酶(PI3K)、Jun 氨基末端激酶、粘著斑激酶和 STAT3/Girdin/Akt 通路。相比之下,破骨細胞中的機械信號轉導機制在很大程度上尚未探索,因為破骨細胞是分化細胞,壽命短,仍然沒有穩定的破骨細胞系。NF-κB 受體激活劑配體(RANKL)對于破骨細胞前體細胞激活和分化為破骨細胞至關重要。然而,尚不清楚機械力如何調節信號通路以促進破骨細胞前體細胞分化和融合成破骨細胞。
侵襲性偽足是一種富含肌動蛋白的膜突出物,能夠介導細胞外基質的局灶降解,在腫瘤細胞侵襲遷移過程中發揮重要作用。在破骨細胞生成過程中,侵襲性偽足在破骨細胞融合中起關鍵作用,環狀侵襲偽足的形成和破骨細胞融合都依賴于 Tks5,這是一種具有 N 端 phox 同源結構域(PX)的銜接蛋白,最初被確定為 Src 底物。
壓力促進破骨細胞成熟和侵襲偽足的形成
抗酒石酸酸性磷酸酶(TRAP)染色一直是鑒定破骨細胞的可靠方法,實驗對受到壓應力的 RAW264.7 細胞進行了 TRAP 染色。與未暴露于壓應力的 RAW264.7 細胞相比,結果發現,暴露于壓應力的細胞中 TRAP 陽性細胞的百分比顯著更高。這表明,壓應力促進破骨細胞的成熟。
此外檢測到,在受到壓應力的 RAW264.7 細胞中形成了侵襲性偽足。用 Tks5 和 F-肌動蛋白抗體進行免疫染色顯示,在暴露于壓應力下,Tks5 和 F-肌動蛋白在 RAW264.7 細胞延伸的侵襲性偽足中積累,并融合了多個細胞。定量分析表明,暴露于壓應力的 RAW264.7 細胞中具有環狀侵襲性偽足的細胞百分比顯著高于未施壓的細胞。這表明,壓應力促進了環狀侵襲性偽足的形成和細胞融合。
壓應力上調 Ets-1 和 Tks5 的表達,促進 Ets-1 在 RAW264.7 細胞中的激活
接下來研究了壓縮應力促進環狀侵襲性偽足形成和細胞融合的分子信號機制。因為 Tks5 是侵襲性偽足形成的主要調節因子,實驗檢測了壓力對 Tks5 表達的影響。
蛋白質印跡分析顯示,與未施壓的細胞相比,在受到壓力的 RAW264.7 細胞中,Tks5 表達在蛋白質水平上調。此外,RT-PCR 分析顯示,與未施壓的細胞相比,在受到壓力的 RAW264.7 細胞中,Tks5 表達在 mRNA 水平上調。這表明,壓力在轉錄水平上調了 Tks5 的表達。
為了確定負責 Tks5 上調的潛在轉錄因子,隨后進行了生物信息學分析,并預測 Ets-1 是驅動 Tks5 表達的候選轉錄因子。此外,先前的研究表明,壓縮力或剪切應力誘導 Ets-1 的上調和激活以調節基因表達。因此,檢查了壓力對 Ets-1 的表達和激活(磷酸化)的影響。
蛋白質印跡分析顯示,與未施壓的細胞相比,在受到壓應力的 RAW264.7 細胞中,Ets-1 蛋白和在 Thr38 處磷酸化的 Ets-1 水平顯著增加。此外,PCR分析顯示,與未施壓的細胞相比,在受到壓應力的RAW264.7細胞中,Ets- 1表達在mRNA水平上調。這表明,壓應力激活 Ets-1 上調 Tks5 表達。
Tks5 是 Ets-1 在 RAW264.7 細胞中的轉錄靶點
熒光素酶測定顯示 Ets-1過表達導致Tks5啟動子的轉錄活性顯著增加,但這可以通過刪除 RAW264.7 細胞中 Tks5 啟動子中預測的 Ets-1 結合位點來消除。此外,暴露于壓應力顯著增加了 Tks5 野生型啟動子區域的轉錄活性,但不增加突變啟動子區域的轉錄活性。然而,由壓應力刺激的 Tks5 野生型啟動子區域增加的轉錄活性被 RAW264.7 細胞中 Ets-1 的敲低消除。總之,這表明 Tks5 在基本條件和壓應力條件下都是 RAW264.7 細胞中 Ets-1 的轉錄靶點。
壓應力誘導 Tks5 上調、侵襲性偽足形成和細胞融合依賴于 Ets-1
總之,該研究證明了 Ets-1 被壓縮應力上調,并且在壓縮應力介導 Tks5 上調、侵襲性偽足形成和破骨細胞融合的作用中至關重要。研究結果為正畸治療期間破骨細胞成熟和融合的機制提供了新的見解。
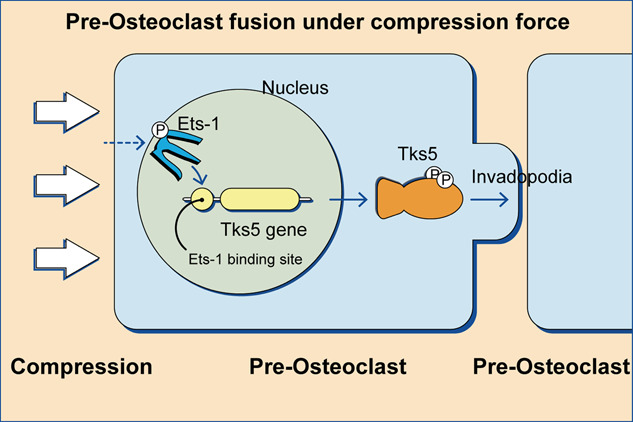
圖1 壓縮應力誘導破骨細胞侵襲偽足形成和細胞融合機制的示意圖。
這項研究發現,壓縮力誘導了 Tks5 的上調,這可以解釋壓縮力如何促進侵襲偽足的形成。基于這些發現提出了一個模型來解釋壓縮力如何促進破骨細胞成熟和融合。壓縮力誘導 Ets-1 上調并導致 Ets-1 在 Thr38 位點磷酸化,接下來激活的 Ets-1 進入細胞核識別 Tks5 基因啟動子區域中的 Ets-1 結合位點并驅動 Tks5 的轉錄,然后 Tks5 促進侵襲性偽足的形成和破骨細胞前體的融合。
參考文獻:Wang Y, Zeng Z, Cheng Y, Zhao L, Yan Q, Qiu Y, Hu J, Guo J. Orthodontic compressive force modulates Ets-1/Tks5 pathway to promote the formation of circumferential invadopodia and the fusion of osteoclast precursors. J Cell Physiol. 2019 Aug;234(8):12685-12691. doi: 10.1002/jcp.27879. Epub 2018 Dec 6. PMID: 30523634.
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,關注公眾號“Natrethink"了解更多細胞仿生培養技術及應用!





