【南方醫科大學學報】HoloMonitor M4應用于登革病毒感染C6/36細胞的3D形態學
基于數字全息顯微術的登革病毒感染C6/36細胞的3D形態學
數字全息顯微術是近年來開始應用于活細胞形態學研究的新技術。采用了數字全息技術與顯微技術相結合方法,特異性測量細胞數目、細胞面積、厚度及體積等細胞形態學評估參數,提供空間、時間、高分辨率的三維形態學圖像,經數據處理轉化為細胞增殖、遷移、活性和細胞死亡等細胞變化過程[13-16]。數字全息顯微術已逐漸應用于細胞水平機制研究中,如通過實時成像技術從原理到應用全過程研究各個階段細胞的病理生理學改變[17]。目前登革病毒感染機制主要通過對相關蛋白、細胞通路、細胞因子等方面的表達與調控進行深入研究,然而對侵襲過程中病毒-細胞膜融合的構象改變形式和方向缺乏有效的研究方法。因此,本研究借助HoloMonitor M4全息細胞成像及分析系統,對登革病毒感染宿主細胞的形態學變化進行實時監控,定量分析病毒感染過程中細胞面積、厚度及體積等各項三維參數的變化,有助于闡明登革病毒感染細胞的細節。同時,此方法對于其他病毒感染機制研究同樣適用,為研究病毒感染過程中的細胞形態學變化提供了新方向。
結果與分析
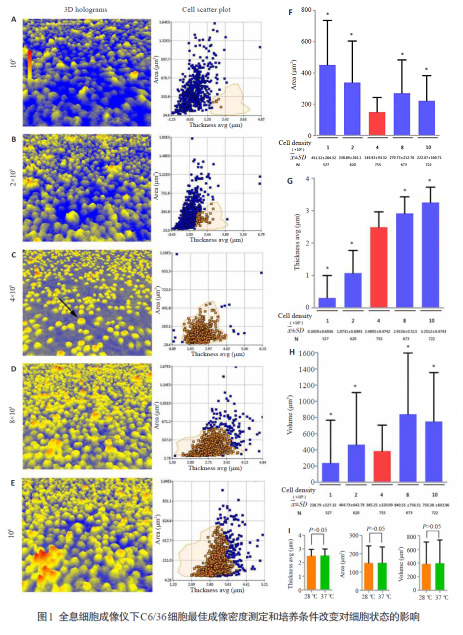
2.1 C6/36細胞全息細胞成像儀下的最佳成像密度
在接種細胞量方面設立105、2×105、4×105、8×105、106個/孔等5個不同條件,對各實驗組過夜培養后進行細胞三維形態學觀察及細胞參數分析,確定開展登革病毒感染C6/36細胞三維形態學實驗最佳密度。結果顯示:實驗3中細胞接種量為4×105時C6/36細胞貼壁后單個細胞生存空間充足,呈良好的圓形三維形態,細胞間形態學表現一致,提示細胞三維成像具有較高統一性。同時,在統計分析中無論是細胞面積、厚度還是體積,實驗組3數據標準差均最小,表明該接種量下離散程度最小,各項指標具有更強的均一性。
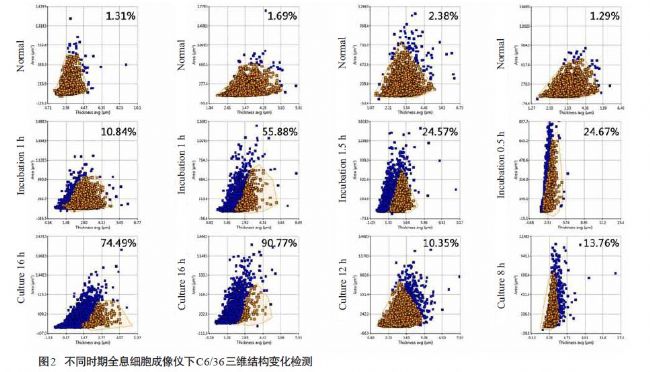
2.2 登革病毒感染C6/36細胞的三維形態學變化
4×105接種量下,C6/36細胞全息圖顯示單個細胞三維形態表現統一,細胞面積、厚度和體積離散程度均最小(P<0.05),確定其為最佳成像密度;轉移至37 ℃、5% CO2培養24 h后細胞厚度、面積和體積改變無顯著性差異(P>0.05);孵育和培養期間4個血清型DENV組
細胞面積和體積增大表現一致,但孵育期間DENV1-4均表現細胞厚度減小不同,培養期間DENV1、2細胞厚度減小而DENV3、4出現截然相反的厚度增大現象。同時,不同血清型間變化趨勢及程度具有各自特異性。

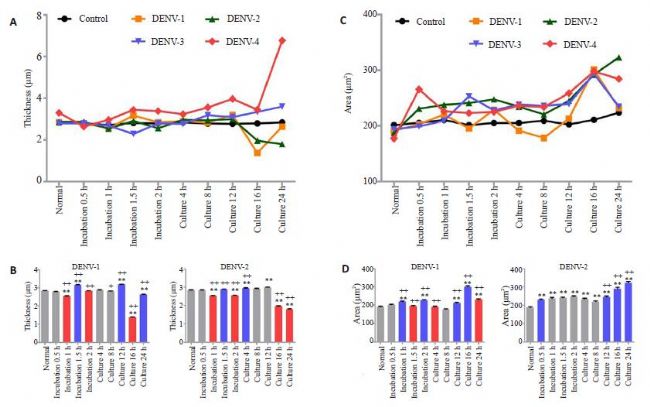
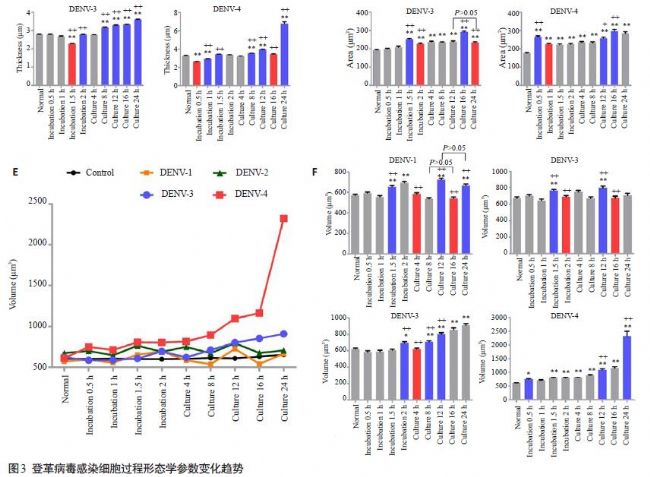
討論:
綜上,本研究建立了一種基于數字全息顯微技術的活細胞形態學檢測新方法,實驗證實通過三維全息圖、形態學參數統計等方式可以全面闡述細胞形態學變化的方向與強度。此方法應用于登革病毒感染C6/36細胞的膜構象改變的探索,有助于全面闡述感染過程中細胞系列膜構象變化趨勢,為深入研究不同血清型登革病毒感染機制奠定基礎。





