分支桿菌WhiB6可以通過調控ESX-1和Dos調節子進而調節肉芽腫的形成和毒力
研究背景
結核分枝桿菌是最成功的胞內病原體之一。其在感染宿主時能夠被巨噬細胞所吞噬,進而形成吞噬體。吞噬體可以進一步的破壞入侵的病原體。但是結核分枝桿菌可以通過一系列的過程來避免吞噬體的消滅,進而來破壞宿主細胞。
研究思路
研究結果
1、 WhiB6調控與ESX-1分泌系統相關基因的表達
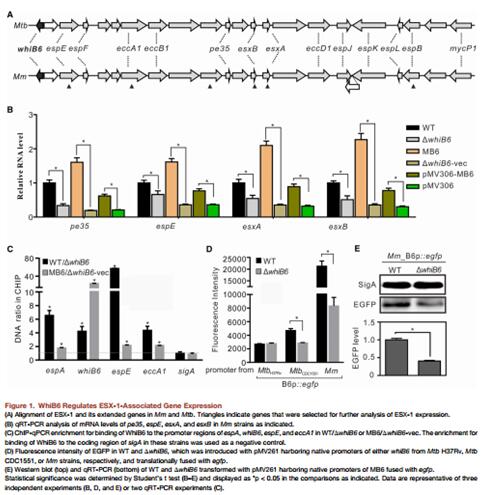
海魚分枝桿菌的MMAR_5437基因(與結核分枝桿菌的WhiB6同源)保守地存在于ESX-1基因附近。通過比對海魚分枝桿菌和結核分枝桿菌的ESX-1基因簇發現,其ORF序列和基因結構都是高度保守的 (Figure 1A)。推測WhiB6是否可以調控ESX-1系統的基因表達。RT-PCR結果發現,在WhiB6敲除株中,ESX-1系統相關基因pe35,espE,esxA, 和esxB的表達量都發生了顯著的下調(Figure1B)。為了進一步研究WhiB6是否可以調控ESX-1相關基因的表達,作者做了chip實驗,結果發現, espA, whiB6, espE,和eccA1基因的啟動子區域在野生型Mm(WT)和互補株MB6 中得到了顯著的富集(相對于WhiB6突變株和互補空載體株 (Figure 1C)。進一步研究WhiB6是否可以進行自身的調控。WT野生株和WhiB6突變株轉入含有分別來自于Mm, MtbH37Rv, 和MtbCDC1551 菌株的融合有egfp熒光標簽的WhiB6啟動子的質粒。熒光定量結果顯示,在Mm和MtbCDC1551菌株熒光強度顯著增高,而MtbH37Rv菌株則沒有(Figure 1D)。Mm菌株的RT-PCR也同樣證實了這個結果(Figure 1E)。
2、 WhiB6 Fe-S 簇對ESX-1的功能起著重要的作用
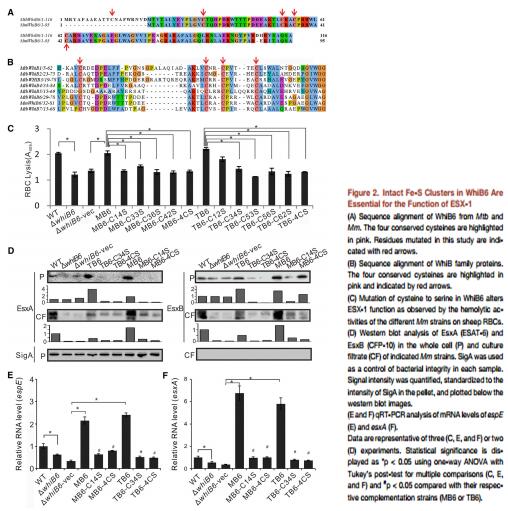
通過比對Mm菌株和Mtb菌株的WhiB6 蛋白的序列發現,它們具有高度的相似性(Figure 2A)。WhiB6蛋白中的四個保守的Cys殘基 (i.e., Mm菌株中的Cys-14, 33, 36,和Mtb菌株中的Cys-34, 53, 56, and 62 inMtb)是非常保守的(Figure 2B)。先前研究發現,ESX-1與溶血相關。因此作者進行了溶血實驗。結果發現,WhiB6突變株與野生株相比,溶血性下降 ,而互補株的溶血性又發生恢復。此外,所有對Cys進行突變了的分枝桿菌的溶血性都發生了顯著的下降(Figure 2C)。此外, 在WhiB6突變株中,ESAT-6 (EsxA)和CFP-10 (EsxB) 的含量也發生了減少,而在互補株中其含量又得到了恢復(Figure 2D)。同樣地,在WhiB6突變株中,ESX-1相關基因的表達量也發生了下降(Figure 2E)。以上這些結果表明,WhiB6的Fe-S對于調控ESX-1是非常重要的。
3、 破壞WhiB6的Fe-S簇可以調控Mm的轉錄模式(轉錄組測序及分析由上海伯豪完成)
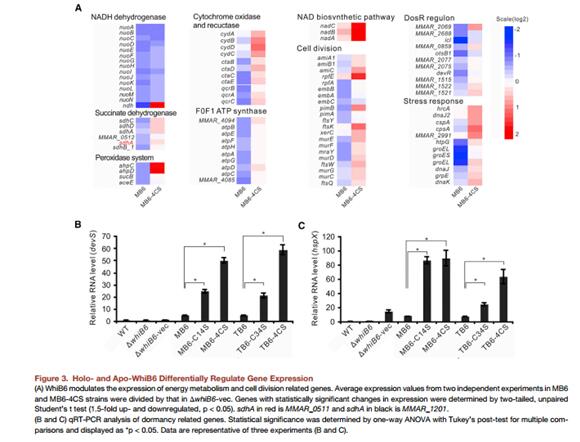
為了進一步確認MB6和MB6-4CS具有不同生長表型的原因,作者檢測了與代謝相關基因的表達情況(Figure 3A)。其中,編碼與細胞色素c通路的電子轉移鏈bc1復合物(qcrCAB),aa3型細胞色素c氧化酶(ctaBCDE)和細胞色素bd(cydABCD)的表達量在MB6中顯著下調。同樣地,編碼F0F1 ATP合成酶的基因的表達量也發生了下降。相反,上述基因的大部分的表達量在MB6-4CS中出現了上調(Figure 3A)。有趣的是,與細胞壁合成相關基因操縱子相關的基因的表達量在MB6中出現了顯著的下調(Figure 3A)。在MB6-C14S和MB6-4CS中,Dos休眠基因 (i.e., devH(mmar_1515)-devR-devS operon)和hspXandtgs1相對于MB6組都出現了顯著的誘導表達 (Figure 3B)。在TB6-C34S和TB6-4CS中也出現了同樣的結果。總之,這些研究結果指向一個假肢切換機制,憑借獨立于apo-WhiB6之外的WhiB6 Fe-S簇可以調控基因的表達。更特別的是,轉錄組數據顯示,WhiB6 Fe-S 簇可以對dos 調節子進行負調控以及對ESX-1分泌系統進行正調控。
4、 WhiB6 與NO反應后可以動態調控ESX-1和Dos 休眠基因的表達
作者添加EDTA-NO后,可以導致在420nm/480nm的吸光度減少,而在300-320nm處的吸光度增加(Figure 4A)。這個結果表明了DNICs的形成。與大部分WhiB蛋白家族相似,WhiB6同樣可以與NO發生反應,進而形成亞硝化 Fe-S簇。為了進一步研究亞硝化WhiB6對ESX-1和DosR表達的調控,作者使用EDTA-NO對MB6, TB6, 和DwhiB6-vec菌株進行不同時間的處理來模擬活化的巨噬細胞的狀態,然后觀察WhiB6的表達(Figure 4B)。結果發現,NO可以誘導whiB6的表達,而其mRNA水平在處理60min后出現了減少 (Figure 4B)。devH-devR-devS操縱子的第一個基因devH的表達情況在MB6 和TB6中相對于whiB6-vec隨著時間的變化出現了增加(Figure 4C)。但是這些差異表達在3小時后逐漸減少(Figure 4C),表明NO和WhiB6以及DosR之間存在著一個復雜的反應過程。假定esxB是WhiB6調控ESX-1分泌系統中起著決定性作用。作者發現,在TB6 和MB6菌株中esxB基因的表達量在NO處理30分鐘后出現了顯著被誘導,而在60分鐘后出現下降(Figure 4D)。有趣的是,在TB6 和MB6菌株中,NO處理3小時后,esxB被顯著的激活 (Figure 4D)。當用300 uM的EDTA-NO處理MB6菌株時,EsxA和EsxB的分泌出現了顯著的降低。這個結果表明,NO可以誘導ESX-1分泌系統的下調。
5、 Isoforms of WhiB6 亞型可以調控Mm的毒力以及在斑馬魚中肉芽腫的形成
基于以上實驗結果,作者推測,WhiB6可以參與到肉芽腫的形成。為了確認此假設,作者檢測了Mm菌株的毒力(5,000 cfu)。結果發現,當斑馬魚感染了MB6和TB6的互補菌株后,他們會出現高的死亡率(Figure 5A),而感染了MB6-4CS 和TB6-4CS卻出現了生存率升高的情況。感染了WT, whiB6突變株,和whiB6-vec(突變株+空載體)也有相同生存率。接下來,為了確定這些疾病的死亡是否是由MB6 和MB6-4CS 形成的肉芽腫引起的,作者又檢測了肉芽腫的形成動力學。在感染2周后(WT和whiB6突變株),巨噬細胞聚集,肉芽腫出現 (Figures 5B and 5D)。斑馬魚感染4周后,肉芽腫更加豐富, 但是有較少的一致的排列不規則的多中心壞死區 (Figures 5C和5E)。 MB6和TB6 可以加速壞死并且加速破壞肉芽腫(Figures 5G和5J)。相反,空載體組就有排列完好的單一中心的壞死的肉芽腫(Figure 5F)。但是當斑馬魚感染了MB6-4CS和TB6-4CS后,只能觀察到很少的肉芽腫,并且只有少數的壞死區(Figures 5H and 5K)。感染4周后, MB6-4CS和TB6-4CS 菌株還能形成排列完好的肉芽腫,并且還有分枝桿菌存在 (Figures 5I 和5L)。實驗結果表明,WhiB6不僅能調控分枝桿菌的毒力,還能調控壞死肉芽腫形成的持續時間。

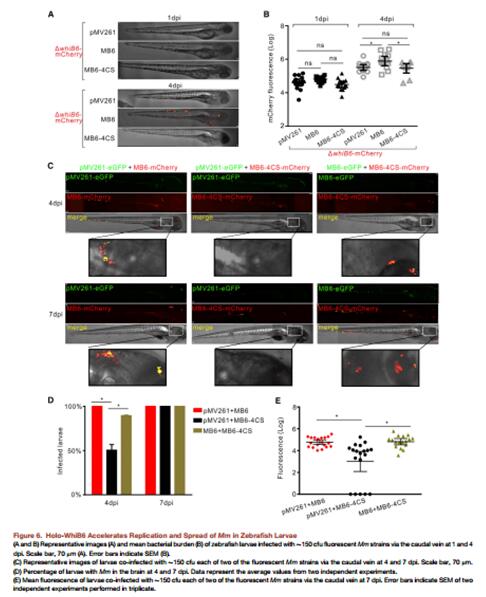
為了研究MB6,MB6-4CS和whiB6突變株(空載體)共感染是否能增加細菌的生存率,以及增加感染的傳播,3個菌株被兩兩結合來進行下一步的研究。當與MB6進行共感染4周后,在斑馬魚的幼體的頭部發現了細菌的存在 (Figures 6C and 6D)。相反,同時感染MB6-4CS和whiB6突變株(空載體)的斑馬魚中的幾乎50%的頭部在感染4周后發現有細菌,但是在7周后沒有(Figure 6D)。在MB6-4CS和whiB6突變株(空載體)感染7周后,可以檢測到細菌的熒光顯著的減少(Figure 6E)。因此,結果表明,WhiB6的壓型可以調控毒力和肉芽腫的形成,并且可以調控Mm在斑馬魚中的復制和傳播。
總結
WhiB6 可以通過Fe-S簇來差異性的調控ESX-1和DosR調節子。本實驗也為研究WhiB6在分枝桿菌的感染,傳播和疾病發展中的作用提供了新的思路。
原文出處:Chen Z, Hu Y, Cumming BM, et al. Mycobacterial WhiB6 Differentially Regulates ESX-1 and the Dos Regulon to Modulate Granuloma Formation and Virulence in Zebrafish. Cell Rep.2016.





