新品直播|新格元單細胞動態轉錄組測序服務上市
新品直播 | 新格元AccuraCell™單細胞動態轉錄組測序服務上市啦

元小新今天帶您來看
DynaSCOPE®+AccuraCode®
結合起來會迸發怎樣的火花

新格元AccuraCell™單細胞動態轉錄組測序技術將AccuraCode®核心原理Well Barcode beads與DynaSCOPE®海量單細胞轉錄動態監測的核心原理RNA代謝標記完美結合,可對單孔中的“新”與“舊”RNA進行轉錄動態監測,將JPG圖片變成GIF動圖,真實動態變化盡在掌握!為研究藥物篩選及早期胚胎發育等方面提供新思路!
GIF動圖快照之法
(1)將細胞短暫暴露于添加有尿嘧啶核苷類似物(S4U)的培養基中以標記新生RNA;
(2)將適量的細胞投入裝有Well Barcoding Beads板中,細胞裂解后帶有獨特Well Barcode及UMI的Well Barcoding Oligo通過polyT序列,對細胞內mRNA分子進行捕獲標記;
(3)收集各樣本孔的Barcoding Beads,對mRNA進行堿基轉換處理,尿嘧啶類似物轉變成胞嘧啶類似物;
(4)反應后,將Barcoding Beads捕獲的mRNA反轉錄為cDNA并擴增,再經過片段化、連接接頭等步驟后構建適用于illumina測序平臺的測序文庫。
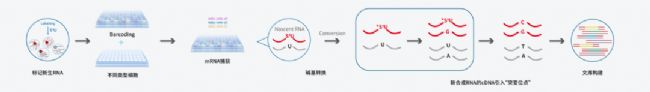
GIF動圖繪制之道
1、一站式解決方案:從RNA捕獲、文庫構建到數據分析全流程;
2、性價比高:構建混合文庫,可降低成本;
3、適用類型廣:適用多種細胞類型,貼壁細胞和懸浮細胞均可;
4、分辨率更高:相比傳統轉錄動態監測技術依靠基因工程等技術,本技術基于RNA測序的轉錄動態監測技術,無需基因工程等技術即可在單細胞層面上監測細胞的轉錄動態;
5、AccuraCell™單細胞測序方案適用于樣本起始細胞少(分選后的細胞或者特殊樣本和珍貴樣本),轉錄組和轉錄速率都可以在單細胞層面分析,不受細胞大小限制。
GIF動圖數據之美
Case1 人鼠皆可繪畫
a實驗設計:小鼠骨髓和人的PBMC分別用S4U標記2h之后,分裝到96孔板內。
對照組:1000細胞投入量,不做堿基轉換;
測試組:1個細胞/孔(每個樣品45個孔),mRNA捕獲后做堿基轉換。
b實驗目的:測試單個細胞投入量下,兩種樣本的基因檢出和轉錄活躍度。
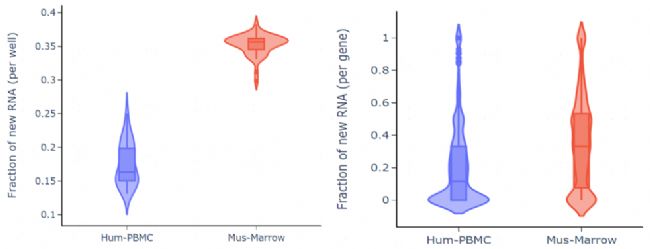
c實驗結論:單個細胞投入下,各樣本的基因檢出數較高(表1),小鼠骨髓的轉錄活性高于人PBMC樣本(圖1A,B)。
d結果展示:
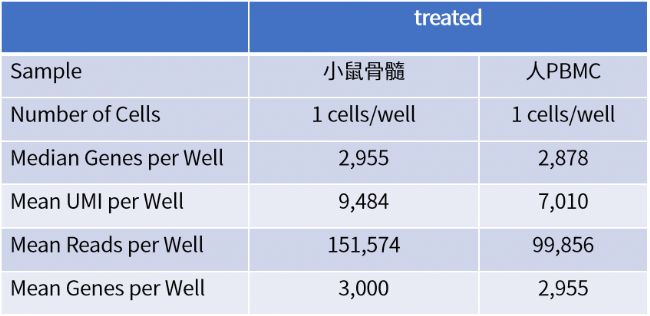
表1 小鼠骨髓和人PBMC樣本質控數據
圖1A 小鼠骨髓和人PBMC樣本T to C突變頻率 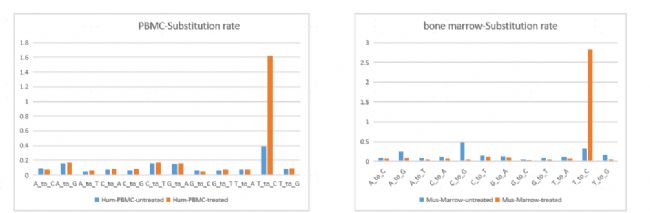

圖1B 細胞層面和基因層面的新生RNA比例
a實驗設計:K562細胞系S4U標記2h,每組的細胞投入量分別為10cells/well、100cells/well、1000cells/well,mRNA捕獲后堿基轉換。
b實驗目的:測試不同細胞投入量下,樣本的轉錄活躍度及試劑盒適配性。
c實驗結論:與untreated對比,堿基轉換處理后T-C堿基轉換率較高(圖2A);投入不同細胞數,基因層面的新生RNA比例相差不大(圖2B);不同細胞投入量,基因表達相關性很好,孔間重復性好(圖2C)。各組樣本的轉錄活躍度較接近,表明該技術可滿足1-1000cell/well的細胞投入量。
d結果展示:
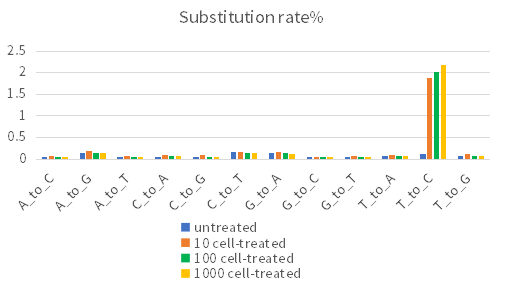
圖2A 堿基轉換率
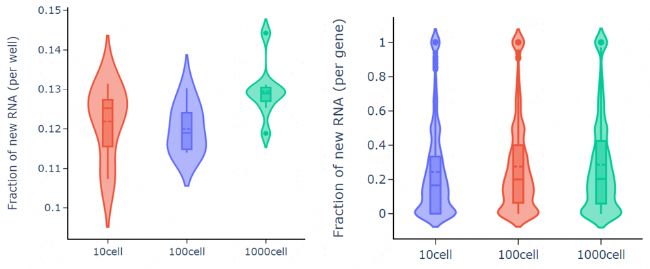
圖2B 細胞層面和基因層面的新生RNA比例
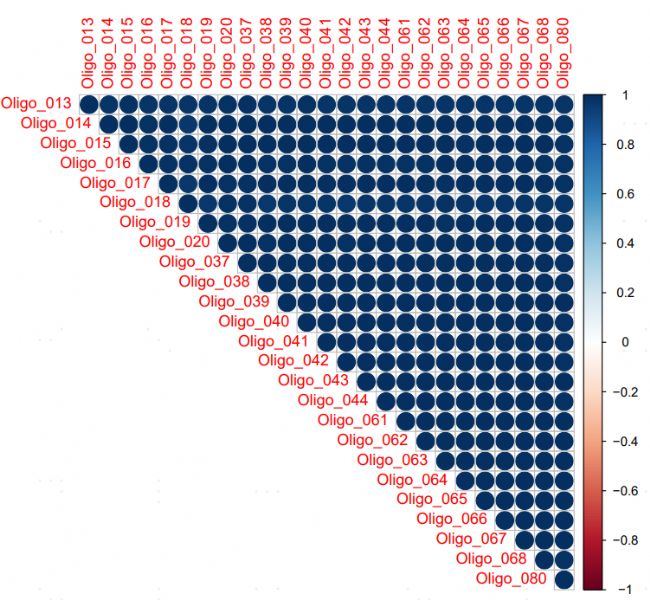
圖2C 相關性分析
Case3 言師采藥來
a實驗設計:人A549細胞系使用藥物處理6h和24h,處理結束前2h加入S4U標記;每組樣本的細胞投入量為100cells/well,mRNA捕獲后堿基轉換。
b實驗目的:測試藥物處理后,樣本轉錄水平的動態變化情況。
c實驗結果:24h的新生RNA比例高于6h(圖3A);轉錄組維度檢測出藥物處理前后數百個基因表達上調或下調(圖3B);在藥物處理24h和空白處理組對比中,通過轉錄動態測序發現一些表達量變化不大,但是轉錄動態變化很大的基因。這些基因通常在普通轉錄組測序中被忽略,但可通過轉錄動態測序挖掘出來,為藥物作用機制和相關通路的分析提供新的思路(圖3C)。
d實驗結論:新生RNA維度檢測出表達量差異不大的基因的轉錄動態的變化,提供了多維度信息。
e結果展示:
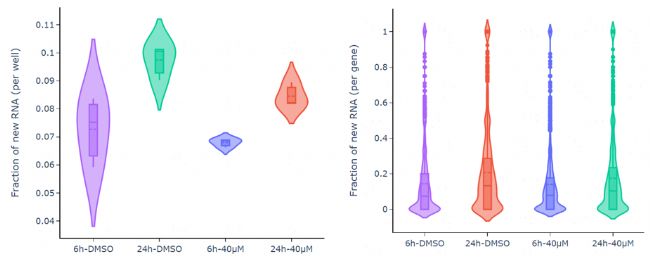
圖3A 細胞層面和基因層面的新生RNA比例
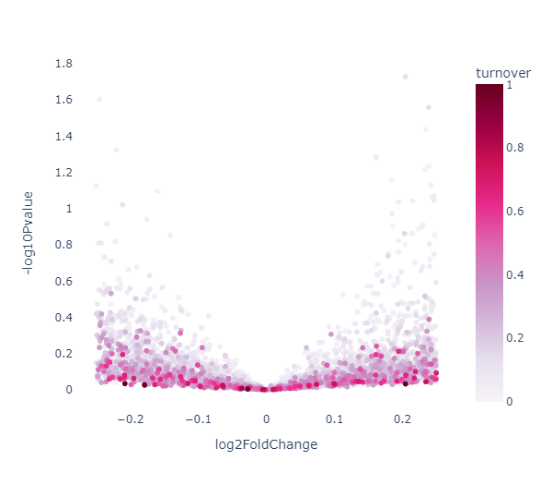
圖3B 藥物處理24h對比空白處理的差異表達基因
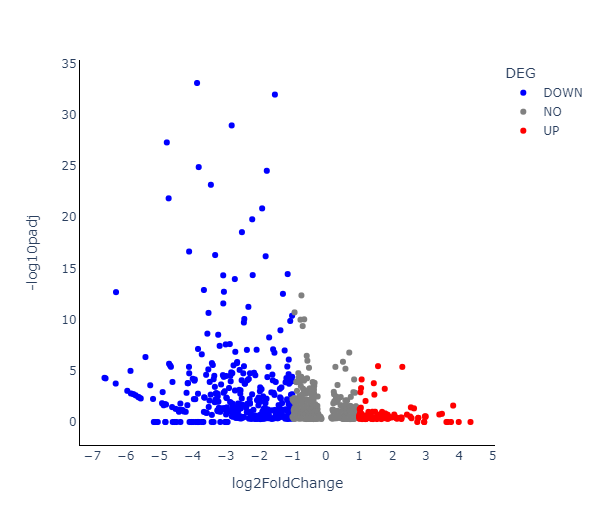
圖3C 新生RNA差異表達火山圖
GIF動圖轉軸之景
1、藥物篩選下轉錄動態的檢測:監測新生RNA水平
該研究用CDK抑制劑處理K562細胞系15min,接著進行45min 4sU孵育。結果顯示總轉錄本水平上無明顯變化,而新合成的轉錄本被大量抑制,更符合藥物處理的結果。所以從新生RNA角度更能體現藥物處理帶來的影響。
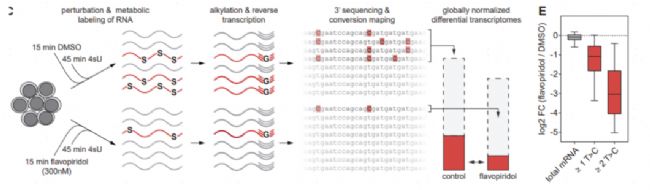
Muhar M, Ebert A, Neumann T, et al. SLAM-seq defines direct gene-regulatory functions of the BRD4-MYC axis. Science. 2018;360(6390):800-805. IF=63.714.
2、檢測不同劑量的藥物觸發不同的轉錄反應
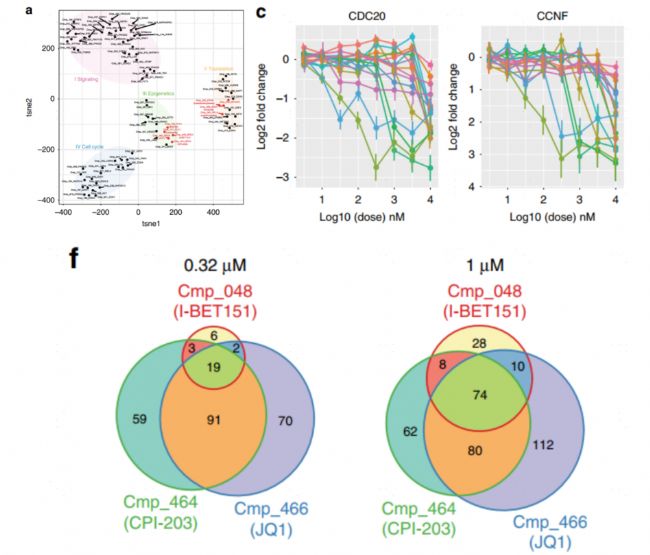
前期研究發現BET抑制劑(JQ1)能調控BRD4基因的轉錄水平,為了研究其轉錄調控機制,對K562細胞系進行了30min不同濃度的JQ1藥物處理,然后用4sU標記60min。研究發現采用低濃度JQ1,轉錄下降有了選擇性(圖A,B),其中發現一些對BET抑制劑處理非常敏感且在AML中非常重要的基因變化顯著,包括MYC等(圖C);CDK9抑制劑(NVP-2)能夠抑制基因的轉錄,而與JQ1處理引起的轉錄改變完全不同,同時用JQ1和低濃度NVP-2處理細胞時,表達譜與同高濃度NVP-2處理比較類似(圖D,E),說明CDK9和BET抑制劑有強協同作用。該研究說明中通量單細胞動態轉錄組測序能幫助我們篩選最優藥物濃度組合。
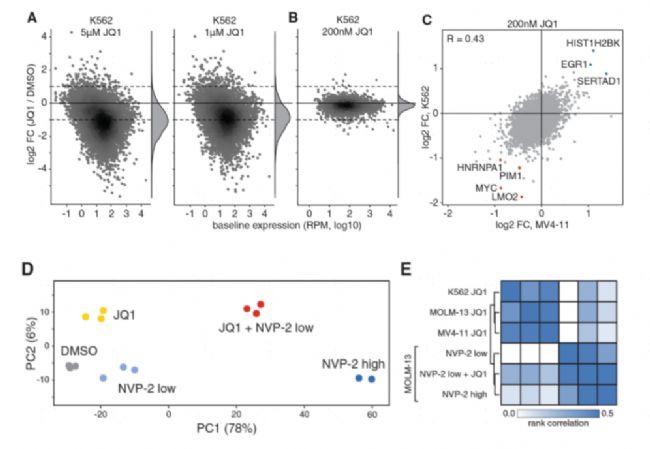
Muhar M, Ebert A, Neumann T, et al. SLAM-seq defines direct gene-regulatory functions of the BRD4-MYC axis. Science. 2018;360(6390):800-805. IF=63.714.
3、同時分析多種細胞+不同種藥物+不同藥物濃度的對比/篩選
高通量篩選是藥物發現的主要手段,很多都是基于靶標和表型的篩選,例如RNA-seq,但通量低,需要開發一種通量更高且成本更低的方法,可以在多個實驗條件下篩選大量化合物。該研究用433種具有靶標藥物性質的化合物處理骨肉瘤U2OS細胞,88個被鑒定為有效化合物(>50個基因顯著改變)。聚類分析得出,同一簇中不同化合物的藥理作用機制(MoA)相同,進而可以推測出同一簇其他靶標化合物的MoA(圖A)。在被干擾細胞周期的藥物處理后,CDC20和CCNF(參與細胞周期功能)被下調(圖C)。不同濃度藥物處理下的細胞基因表達具有差異(圖F)。該研究僅為藥物處理后某一時間點的轉錄情況,AccuraCell™單細胞動態轉錄組測序可在其基礎上添加時間維度,研究藥物處理一段時間內的轉錄動態變化,從新生RNA角度更能體現藥物引起的直接轉錄變化,深層次解析藥物響應機制。
 Muhar M, Ebert A, Neumann T, et al. SLAM-seq defines direct gene-regulatory functions of the BRD4-MYC axis. Science. 2018;360(6390):800-805. IF=63.714.
Muhar M, Ebert A, Neumann T, et al. SLAM-seq defines direct gene-regulatory functions of the BRD4-MYC axis. Science. 2018;360(6390):800-805. IF=63.714.直播信息
AccuraCell™單細胞動態轉錄組測序解決方案面對面啦!掃碼報名,讓我們相約2022年12月1日14:00,觀看直播,更有驚喜好禮相送~

- 新型FluorCam葉綠素熒光儀上市,助力設備以舊換新
- 中喬新舟推出HUVEC轉染試劑,獨家破解基因轉染壁壘
- 徠卡即將推出Visoria B/M/P三款新型正置手動顯微鏡
- 博鷺騰2025年合作伙伴大會圓滿成功并發布多款新品
- 上海優耳推出動物行為獎勵飼料,助力實驗動物研究
- 韓國LCI推出新一代組織透明化澄清液 Opti Mount
- 奧豪斯推出全新DEFENDER系列 DF2500電子平臺秤
- 銳視科技重磅發布全鏈條動物影像和生物輻照產品矩陣
- EVIDENT推出EviStar奧之星ES818顯微互動教學系統
- 艾普拜qMate mini新品上市,全面布局分子檢測產品線
- 勤翔新品IVScope8000M全光譜小動物活體成像系統試用
- 打破邊界精準進化,NEOSCAN推出NXL臺式大倉顯微CT
- 德國IKA歐洲之星EUROSTAR系列頂置攪拌器煥新升級
- 賽默飛蘇州TSX通用系列國產化超低溫冰箱震撼上市
- 勤翔發布新品IVScope 8000Pro小動物活體成像系統
- 2025伯豪生物春季全國巡講開啟,早鳥報名搶占先機
- 華大智造副總裁中國區總經理彭歡歡一行到訪伯豪生物
- 伯豪董事長出席專精特新中小企業發展壯大論壇并發言
- 伯豪生物雙11狂歡特惠活動來襲,限時限量搶
- 怡美通德推出成本價體驗單細胞測序(FFPE或全血)
- 伯豪生物2024系列培訓班(陜西站)報名開啟
- 伯豪單細胞Flex年中巨惠,1.1W/樣本活動價即將截止
- 藍景科信DAP-seq技術相關文章6連發,總IF 95.2
- 伯豪生物2024單細胞空轉生信培訓8月直播課開啟報名
- 中生柏奧成為德國LenioBio中國區合作伙伴
- 伯豪生物與騰云生物達成戰略合作共推科技服務新發展
- 云平臺賦能,伯豪單細胞分析云流程正式上線
- 伯豪生物直播預告:單細胞技術在臨床科研中的應用
- 伯豪生物空間轉錄組&Olink蛋白質組多重優惠限時促銷
- 伯豪直播:單細胞RNA測序腎病機制研究與生信云實操
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






